麦济生物MG-K10临床试验,MG-K10人源化单抗注射液治疗中重度特应性皮炎的II期临床试验
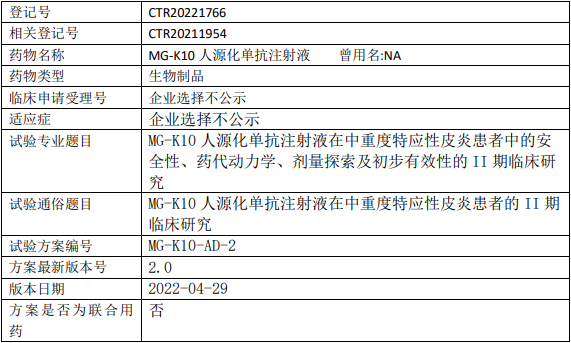
试验目的
主要目的
评估MG-K10人源化单抗注射液在中重度AD患者中多次给药的初步有效性。
次要目的
1、评估MG-K10人源化单抗注射液在中重度AD患者中多次给药的安全性、耐受性。
2、开展MG-K10人源化单抗注射液在中重度AD患者中的剂量探索,评估MG-K10人源化单抗注射液在中重度AD患者中多次给药的PK、PD特征和免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18~70岁(包含18和70岁),男女均可;
2、符合美国皮肤病学会共识标准(2014年)确诊的AD患者,筛选前诊断AD或湿疹病史≥半年,并符合以下条件:
-筛选和基线访视时EASI≥16;
-筛选和基线访视时IGA≥3;
-筛选和基线访视时,AD受累面积BSA≥10%;
-筛选前半年内接受至少4周强效或2周超强效外用糖皮质激素(超强效:0.1%氟轻松乳膏、0.05%氯倍他索乳膏;强效:0.05%卤米松乳膏、0.05%二丙酸倍他米松乳膏、0.1%戊酸倍他米松乳膏、0.25%去羟米松软膏剂及乳膏)或4周外用钙调神经磷酸酶抑制剂治疗,或曾系统使用糖皮质激素或免疫抑制剂2周以上但疾病不能充分被控制;
3、育龄期女性首次给药前7天之内血妊娠检查结果为阴性;-育龄期女性包括所有月经初潮且未实施绝育术(如子宫切除、两侧输卵管结扎或双侧卵巢切除)或未绝经的女性。绝经女性定义为无其他原因连续≥12个月闭经;或月经周期不规则进行激素替代治疗(HRT),血清滤泡刺激激素(FSH)水平>35mIU/mL的女性;
4、受试者及伴侣同意从签署知情同意书(ICF)到治疗结束后6个月采取有效的避孕措施
5、自愿签署ICF,且能遵守方案要求全部访视以及研究相关程序,包括能够独立完成受试者问
排除标准
1、受试者目前存在可能影响AD评价的其他活动性皮肤病(如银屑病或红斑狼疮)的诊断
2、已知对本药任一组分过敏
3、受试者不能耐受静脉穿刺,或有晕针或晕血史者
4、受试者合并有可能需要进行系统性激素治疗或其他干预措施或需要积极频繁的监测的疾病
5、有明显心、肺、胃肠道、肝、肾、血液、神经和心理疾病的,且病情不稳定或未能得到很好控制者,研究者认为有临床意义者。如预期生存期短于3个月的患者、未受控制的糖尿病患者(糖化血红蛋白[HbA1c]≥9%)、有心血管疾病的患者[如心功能≥3级(NYHA分级)]、严重的肾脏疾病(如接受透析的患者)、肝胆疾病(如Child-PughB级或C级)、神经系统疾病(如脱髓鞘疾病)、活动期的自身免疫性疾病(如红斑狼疮、炎症性肠病和类风湿性关节炎)等。“有临床意义”定义为研究者认为参与研究会对受试者的安全性造成风险或研究期间疾病/病症加重时会影响有效性或安全性分析
6、患有研究者判断不适合入组的眼部疾病患者,包括目前正在使用激素或免疫抑制剂治疗的眼部炎症者(结膜炎、眼睑炎和角膜炎等);如果研究者不能判断时,需请眼科医生进行诊断
7、计划在研究期间接受重大手术者,包括住院手术和日间门诊手术
8、5年内有恶性肿瘤的患者(注:①患有已经被切除且至少3年没有复发或病灶转移性证据的宫颈原位癌患者可参加本研究。②患有已经完全切除且至少3年没有复发的基底细胞或鳞状上皮癌的患者可以参加本研究)
9、受试者存在以下情况:
-随机前12周内使用过生物制剂者或未超过5个半衰期(以较长时间为准);
-随机前4周内使用过靶向抑制剂(如JAK抑制剂等)、系统糖皮质激素、环孢素及其他免疫抑制剂(如甲氨蝶呤、霉酚酸酯[MMF]及硫唑嘌呤等)、磷酸二酯酶(PDE4)抑制剂、紫外线治疗、针对AD的全身或局部中药治疗;
-随机前1周内接受过外用糖皮质激素、外用钙调磷酸酶抑制剂、抗生素复方乳膏等局部治疗AD的药物;
-筛选前6个月接受过变应原特异性免疫治疗;-筛选前3个月内或计划在研究期间接种活疫苗/减毒活疫苗;
-筛选前3个月或者5个半衰期(以时间较长者为准)参加了其他药物临床研究,或计划在研究期间参加其它药物临床研究;
-参与并使用过本研究药物或相同靶点的其他药物临床研究;
10、筛选前4周至基线访视接受全身性(口服及静脉)抗细菌、病毒、真菌治疗者;当前有任何症状、体征或实验室检查异常提示可能存在急性或者亚急性感染者(如发热、咳嗽、尿急、尿痛、腹痛、腹泻、皮肤感染性伤口等);疱疹病毒感染者;
11、有活动性结核病的证据,或者以前曾经有活动性结核病证据而且没有接受过适当的有记录的治疗;筛选前的3个月内/筛选期内胸部X线检查或CT等检查提示存在活动性结核感染;
12、筛选前半年内有寄生虫感染病史或前往寄生虫病流行地区(南美和非洲)
13、筛选时实验室检查结果出现以下任何一项异常:
1)中性粒细胞绝对计数(ANC)<1.2×109/L
2)总胆红素、天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)>2×正常值上限(ULN)
3)肌酐>2×ULN,研究者判定有临床意义
4)血小板计数<75×109/L5)其他实验室检查异常有临床意义,研究者判断不适合入组者出现以上所述的任何实验室异常的情况下,可在获得初始数据后的1周内再重复一次检测,重复检测所得到测量值如果满足合格标准,则也可具有入组资格;
14、筛选时12导联心电图(ECG)异常,而且研究者或申办者认为该异常具有临床意义并且可能会给患者参与本研究带来不可接受的风险(例如,Fridericia校正QT间期>500msec);
15.、筛选时,HBsAg、HBeAg、HCVAb、HIVAb、梅毒螺旋体抗体中任意一项阳性
16、有吸毒史、药物滥用史、酗酒史者
17、筛选前3个月内献血或大量失血(≥400ml),接受输血或使用血制品者
18、哺乳期或妊娠期妇女,或者计划在研究期间妊娠或哺乳的妇女;
19、研究者认为有其他不适合参加研究的情况者。
研究者信息
主要研究者
姓名:徐金华
学位:医学博士
职称:主任医师
单位名称:复旦大学附属华山医院
各参加医院
| 序号 | 参加医院 | 主要研究着 | 医院地址 |
| 1 | 复旦大学附属华山医院 | 徐金华 | 上海市静安区乌鲁木齐中路12号 |
| 2 | 上海市皮肤病医院 | 丁杨峰、史玉玲 | 上海市静安区保德路1278号 |
| 3 | 首都医科大学附属北京友谊医院 | 李邻峰 | 北京市西城区永安路95号 |
| 4 | 杭州市第一人民医院 | 吴黎明 | 浙江省杭州市上城区浣纱路261号 |
| 5 | 中国科学院大学宁波华美医院 | 王金燕 | 浙江省宁波市海曙区西北街41号 |
| 6 | 中南大学湘雅三医院 | 鲁建云 | 湖南省长沙市岳麓区桐梓坡路138号 |
| 7 | 四川大学华西医院 | 黎静宜 | 四川省成都市武侯区国学巷37号 |
| 8 | 浙江省人民医院 | 陶小华 | 浙江省杭州市拱墅区上塘路158号 |
| 9 | 福建医科大学附属第一医院 | 纪超 | 福建省福州市台江区茶中路20号 |
| 10 | 广州医科大学附属第一医院 | 李靖 | 广东省广州市越秀区沿江西路151号 |
| 11 | 中山大学孙逸仙纪念医院 | 郭庆 | 广东省广州市越秀区沿江西路107号 |
| 12 | 江苏大学附属医院 | 李遇梅 | 江苏省镇江市京口区解放路438号 |
| 13 | 南方医科大学皮肤病医院 | 梁云生 | 广东省广州市越秀区麓景路2号 |
| 14 | 杭州市第三人民医院 | 许爱娥 | 浙江省杭州市上城区西湖大道38号 |
| 15 | 昆明医科大学第二附属医院 | 邓丹琪 | 云南省昆明市五华区滇缅大道374号 |
| 16 | 北京清华长庚医院 | 赵邑 | 北京市昌平区立汤路168号 |
| 17 | 中国医学科学院皮肤病医院 | 顾恒 | 江苏省南京市玄武区蒋王庙街12号 |
| 18 | 广东省人民医院 | 万建绩 | 广东省广州市越秀区中山二路106号 |
| 19 | 蚌埠医学院第一附属医院 | 谢芳 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 20 | 天津市中医药研究院附属医院 | 张理涛 | 天津市红桥区北马路354号 |
| 21 | 上海长海医院 | 吴建华 | 上海市杨浦区长海路168号 |
| 22 | 浙江大学医学院附属第四医院 | 刘伦飞 | 浙江省金华市义乌市商城大道N1号 |
| 23 | 中一东北国际医院(有限公司) | 张士发 | 辽宁省沈阳市浑南区天赐街2号 |
| 24 | 北京大学第三医院 | 张春雷 | 北京市海淀区花园北路49号 |
| 25 | 沧州市人民医院 | 秦兰英 | 河北省沧州市新华区清池大道7号 |
| 26 | 延安大学咸阳医院 | 陈小艳 | 陕西省咸阳市渭城区文林路38号 |
| 27 | 安徽医科大学第一附属医院 | 杨森 | 安徽省合肥市蜀山区绩溪路218号 |
| 28 | 陆军军医大学第二附属医院 | 王儒鹏 | 重庆市沙坪坝区新桥正街83号 |