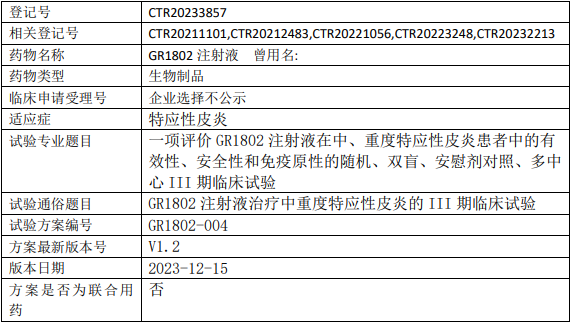
智翔GR1802临床试验,评价GR1802注射液治疗中、重度特应性皮炎有效性、安全性和免疫原性的III期临床试验
试验目的
主要目的
评价GR1802注射液在中、重度特应性皮炎患者中的疗效。
次要目的
1、评价GR1802注射液在中、重度特应性皮炎患者中的安全性;
2、评价GR1802注射液在中、重度特应性皮炎患者中的药代动力学特征;
3、评价GR1802注射液在中、重度特应性皮炎患者中的药效学效应;
4、评价GR1802注射液在中、重度特应性皮炎患者中多次皮下注射的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18-75(包括两端)周岁。
2、筛选时符合Williams诊断标准,且筛选时患病时间至少1年,并且:
●筛选访视和基线访视时湿疹面积和严重程度指数(EASI)评分≥16分;
●筛选访视和基线访视时研究者整体评估(IGA)评分≥3分;
●筛选访视和基线访视时特应性皮炎(AD)累及体表面积(BSA)≥10%;
●基线访视时每日峰值瘙痒NRS评分的周平均值≥4分。
3、筛选前6个月内对治疗AD的外用糖皮质激素治疗应答不足或不耐受:
●应答不足定义为尽管使用中效至超强效外用糖皮质激素(TopicalCorticosteroids,TCS)治疗AD,给药至少28天或药品处方信息中推荐的最长持续时间(例如,超强效TCS为14天)(以较短时间为准)仍未能达到并维持缓解或低疾病活动度状态(相当于IGA0=完全清除至2=轻度);
●筛选前6个月内使用过足量全身性(由研究者判断)糖皮质激素治疗AD视为满足TCS治疗应答不足。
4、基线前稳定地使用润肤剂至少7天。
5、能够理解并遵守临床方案要求,自愿参加临床试验,患者或其法定代理人签署书面知情同意书。
排除标准
1、经询问有淋巴增生性疾病病史;或目前患有恶性肿瘤或者有恶性肿瘤史(经根治后获得完全缓解后超过5年且没有任何复发迹象的皮肤原位鳞癌,基底细胞癌和原位宫颈癌除外)。
2、有重要器官移植(如:心、肺、肾、肝)或造血干细胞/骨髓移植史。
3、筛选时可能存在活动性结核感染。
4、基线访视前4周内因慢性或急性活动性感染需要使用全身性抗感染治疗,并经研究者评估可能会增加受试者风险;若基线访视前存在需要全身性治疗的浅表皮肤感染,感染症状消退后可继续筛选。
5、筛选时存在急性结膜炎、急性角膜炎。
6、有严重的疱疹病毒感染史,如:疱疹脑炎、播散性疱疹等。
7、筛选或基线时存在可能干扰研究评估的皮肤合并症(如荨麻疹、以结节样皮损为主要表现的湿疹等)。
8、基线时受试者正处于AD急性加重状态(如受试者存在短期内快速发展的红皮病或红皮病倾向等,以研究者判断为准)。
9、基线前8周内接受过活/减毒疫苗接种或计划在试验期间接受活/减毒疫苗接种。
10、怀疑或确认对试验用药品(含辅料、同类药物)过敏,以及罹患严重性过敏性疾病(本疾病除外)或属于过敏体质者,经研究者判断可能使受试者安全受到损害。
11、具有生育能力的女性和/或男性及其伴侣拒绝自签署知情同意书后至末次给药后6个月内:采取高效(女性受试者及其伴侣)/有效(男性受试者及其伴侣)的避孕措施、有生育、捐献卵子计划(女性)或捐献精子计划(男性)。
12、患有研究者认为参加临床试验可能会造成受试者安全风险的严重基础疾病(包括心血管系统、内分泌系统、血液系统、神经/精神疾病等)。
13、筛选时存在以下实验室检测异常:
●血红蛋白(男性)<10.0g/dL(100.0g/L),或(女性)<9.0g/dL(90.0g/L);
●白细胞总数<3.0×10^9/L。中性粒细胞数<1.5×10^9/L;
●血小板计数<90×10^9/L。丙氨酸氨基转氨酶(ALT)和/或天冬氨酸氨基转氨酶(AST)>2倍正常值上限(ULN);
●血清肌酐>1.2倍ULN。总胆红素>1.5倍ULN;
●碱性磷酸酶>1.5倍ULN。其他实验室检查异常经研究者判断可能影响受试者完成试验或严重干扰安全性评估。
14、筛选时乙型肝炎表面抗原阳性(HBVDNA检测低于500IU/ml除外)、乙型肝炎核心抗体阳性(HBVDNA检测低于500IU/ml除外);丙型肝炎病毒抗体阳性、人类免疫缺陷病毒(HIV)抗体阳性、抗梅毒螺旋抗体(TP-Ab)阳性(RPR或TRUST阴性者除外)。
15、妊娠或哺乳期,或计划在研究期间妊娠、哺乳的妇女。
16、基线访视前6个月内接受过过敏原免疫治疗。
17、基线访视前4周内接受过:系统性免疫抑制/免疫调节药物治疗(如,全身性糖皮质激素、环孢素、霉酚酸酯、干扰素γ(IFN-γ)、硫唑嘌呤、甲氨蝶呤、雷公藤及其提取物制剂、Janus激酶抑制剂等)或系统性光疗。
18、基线访视前2周内接受过:针对AD的外用糖皮质激素、外用钙调磷酸酶抑制剂、外用磷酸二酯酶抑制剂4(PDE-4抑制剂),以及其他外用免疫抑制/免疫调节药物,局部或全身中草药/中成药治疗。
19、接受过单抗类生物制剂治疗:基线访视前5个药物半衰期或10周(以较长时间为准)内。
20、基线前1周内接受过口服抗组胺药(随机前已接受稳定剂量口服抗组胺药至少1周的除外)。
21、基线前1周内接受过以上排除标准罗列之外的,经研究者判断认为对AD有治疗作用的其他药物。
22、既往接受过GR1802注射液治疗或基线访视前4周内参加过其它临床试验且入组治疗。
23、计划在研究期间进行重大手术。
24、研究者认为不合适参加本试验的其他原因。