幼年特发性关节炎诊断标准和幼年特发性关节炎治疗指南
内容摘要
幼年特发性关节炎(JIA)临床上常见亚型包括全身型JIA、少关节型/多关节型JIA和幼年脊柱关节炎。本病无特异性诊断指标,需与感染性疾病和恶性病相鉴别。全身型JIA起病多急骤,病情进展快,易合并巨噬细胞活化综合征而危及生命。
儿童风湿科医生对JIA的诊断及治疗经验仍不足,规范化诊疗水平有待进一步提高。
中华医学会风湿病学分会组织有关专家,在借鉴国内外诊疗规范和分类标准的基础上,制定本规范,旨在规范JIA各亚型及全身型JIA合并巨噬细胞活化综合征的诊断和治疗方案,以降低致死率和严重并发症的发生率,从而改善患儿预后。
幼年特发性关节炎(JIA)是儿童时期常见的风湿性疾病,以慢性关节滑膜炎为主要特征,并伴有全身多脏器功能损害,亦是造成儿童时期残疾和失明的重要病因。
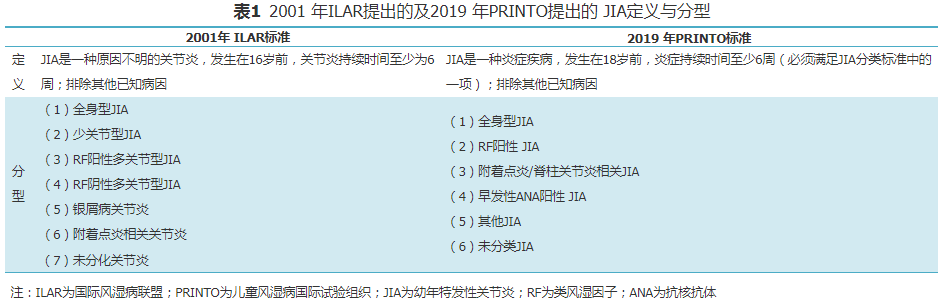
JIA定义是16岁前起病,持续6周或6周以上的单关节炎或多关节炎,并除外其他已知病因。JIA的每一型均需除外其他可能的疾病。
2001年国际风湿病联盟(ILAR)将JIA分为全身型、类风湿因子(RF)阳性多关节型、RF阴性多关节型、少关节型、附着点炎相关关节炎(ERA)、银屑病关节炎(PsA)和未分化关节炎7个亚型[1](表1)。
2019年儿童风湿病国际试验组织(PRINTO)提出JIA新的分型标准[2],将JIA的年龄划分标准16岁改为18岁,删去2001年ILAR提出的少关节型JIA、RF阳性多关节型JIA、RF阴性多关节型JIA和PsA,新增RF阳性JIA、早发性ANA阳性JIA(表1)。幼年脊柱关节炎(SpA)包括ERA和PsA。巨噬细胞活化综合征(MAS)是风湿性疾病常见的严重并发症,尤其易继发于全身型JIA。中华医学会风湿病学分会组织有关专家,在借鉴国内外诊治经验和指南的基础上,制定本规范,本规范将对各型JIA进行介绍。
全身型幼年特发性关节炎
全身型JIA是儿童时期以高炎症状态为特点的一种发热、出疹性疾病,约占JIA患儿的10%。全身型JIA定义是关节炎伴随全身临床症状,典型的弛张热,每日高峰超过39 ℃或更高,持续时间超过2周,至少合并下述症状之一:易消散的皮疹,淋巴结肿大,多浆膜炎或肝脾肿大。全身型JIA可发生于任何年龄,但以5岁前略多见,无明显性别差异,发病率大约是10/10万。
由于全身型JIA无特异性诊断指标,需与感染性疾病和恶性病鉴别,且本病起病多急骤,病情进展快,易合并MAS而危及生命,儿童风湿科医生对这种儿童危重症的经验欠缺,规范化诊疗水平有待进一步提高,本文旨在规范全身型JIA的诊断与治疗方案,以降低致死率和严重并发症的发生率,改善患儿预后。
一、临床表现
1. 发热:弛张型高热是本病的特点,体温每日波动于36~41 ℃之间,骤升骤降,一日内可出现1~2次高峰,高热时可伴寒战和全身中毒症状,如乏力、食欲减退、肌肉和关节疼痛等,热退后患儿活动如常,无明显痛苦。发热可持续数周至数月,自然缓解后常复发。
2. 皮疹:亦是本病典型症状,其特征为发热时出现,随着体温升降而出现或消退。皮疹呈淡红色斑丘疹或荨麻疹样皮疹,可融合成片。可见于身体任何部位,但以胸部和四肢近端多见。
3. 关节症状:关节痛或关节炎是主要症状之一。发生率在80%以上。可为多关节炎或少关节炎。常在发热时加剧,热退后减轻或缓解。以膝关节最常受累,手指关节、腕、肘、肩、踝关节亦常受累。反复发作数年后,部分患儿可形成关节强直。关节症状既可首发,又可在急性发病数月或数年后才出现。半数以上患儿有不同程度肌肉酸痛,多在发热时明显。
4. 肝脾及淋巴结肿大:约半数患儿有肝脾肿大,可伴有轻度肝功能异常,少数患儿可出现黄疸。体温正常后肝脾可缩小。多数患儿可有全身淋巴结肿大,肠系膜淋巴结肿大时可出现腹痛。
5. 胸膜炎及心包炎:约1/3患儿出现胸膜炎或心包炎。但无明显症状,心肌亦可受累,但罕见心内膜炎。少数患儿可有间质性肺炎。
6. 神经系统症状:部分患儿出现脑膜刺激症状及脑病的表现,如头痛、呕吐、抽搐、脑脊液压力增高及脑电图改变。
二、辅助检查
1. 血常规:白细胞计数和中性粒细胞计数明显升高,白细胞计数可高达(30~50)×109/L,并有核左移;中度贫血、正常红细胞性贫血;血小板计数增高,特别是病情加剧者。
2. 红细胞沉降率(ESR)和C反应蛋白(CRP)明显升高。
3. 其他化验指标:重症患儿可有肝酶、血清铁蛋白、凝血功能的异常,并伴有多克隆高球蛋白血症。
4. 影像学检查:关节影像学检查有助于了解关节病变情况,心电图、心脏彩色超声、胸部CT和头颅CT等有助于评估脏器受累情况,必要时行头颅磁共振成像(MRI)。
三、全身型JIA的分型标准
1)2001年ILAR提出并修订JIA分型标准:
诊断标准:一个至多个关节受累,伴有至少持续2周的发热,其中至少有3 d每天均出现弛张热(热峰≥39 ℃每天1次,可降至≤37 ℃),同时满足下述1项或以上内容:(1)可消退的(不固定的)红斑样皮疹;(2)淋巴结肿大;(3)肝或脾肿大;(4)浆膜炎。
排除标准:
(1)有银屑病或一级亲属有银屑病病史;
(2)6岁后起病的男性且人类白细胞抗原(HLA)-B27阳性的关节炎患儿;
(3)有强直性脊柱炎、附着点炎相关关节炎、炎症性肠病中有骶髂关节炎表现、急性前葡萄膜炎病史,或一级亲属中有上述病史;
(4)间隔3个月查RF至少有2次阳性。
2.)2019年PRINTO提出JIA新的分型标准,强调JIA是一种炎症性疾病,与疾病的本质更加贴近,另外强调了白细胞计数在全身型JIA诊断中的重要作用。
诊断标准:不明原因发热(排除感染、肿瘤、自身免疫病或单基因型自身炎症性疾病)每天记录体温(发热,热峰≥39 ℃,每日至少1次,在2个热峰之间降至≤37 ℃),至少连续3 d,发热持续时间至少2周,并伴有2个主要标准或1个主要标准及2个次要标准,主要标准:(1)可消退的(不固定的)红斑样皮疹;(2)关节炎。
次要标准:
(1)全身淋巴结肿大和/或肝肿大和/或脾肿大;
(2)浆膜炎;
(3)关节痛持续时间>2周(无关节炎);
(4)外周血白细胞计数增多(≥15 000/mm3)。
四、治疗方案及原则
1. 糖皮质激素(医学简称激素):全身型JIA轻症只需口服非甾体抗炎药(NSAIDs),若发热和关节炎未能为足量NSAIDs所控制时,可加服泼尼松0.5~1 mg·kg-1·d-1,1次顿服或分次口服,一旦得到控制即逐渐减量至停药。合并心包炎则需大剂量泼尼松2 mg·kg-1·d-1,分3~4次口服,待控制后逐渐减量至停药,或甲泼尼龙冲击治疗,10~30 mg·kg-1·d-1,最大量不超过1 000 mg,每日1次,连续3d,随后口服小剂量泼尼松。
2. 改善病情抗风湿药(DMARDs):又称慢作用抗风湿药(SAARDs)。如甲氨蝶呤、环孢素A。甲氨蝶呤每周口服10~15 mg/m2,最大剂量为15 mg,如口服效果欠佳或出现恶心、呕吐及转氨酶增高,可酌情短期停用。环孢素A 2~3 mg·kg-1·d-1,分2次口服,定期查血常规和肝功能,并密切监测血压。其他免疫抑制剂可选用环磷酰胺和硫唑嘌呤,均需定期查血常规和肝功能。需注意的是,有些DMARDs有诱发全身型JIA并发MAS的可能(如柳氮磺嘧啶、甲氨蝶呤)。沙利度胺具有特异性免疫调节作用,能抑制单核细胞产生肿瘤坏死因子(TNF),还能协同刺激人T淋巴细胞,辅助T细胞应答,并可抑制血管形成和黏附分子活性。沙利度胺可有效缓解关节症状和控制体温,安全性亦较好。
3. 生物制剂:全身型JIA根据病程不同,针对慢性反复发作型和持续活动型,传统的激素联合免疫抑制剂的治疗效果甚微,且长期应用引起的相关不良反应显著。因此,生物制剂成为治疗全身型JIA的新武器。TNF受体拮抗剂、白细胞介素(IL)-1受体拮抗剂、IL-6受体拮抗剂在全身型JIA患儿的疗效已引起医学界的关注和认可,且IL-1受体拮抗剂、IL-6受体拮抗剂的效果更好。但目前国内尚无IL-1受体拮抗剂。
托珠单抗是一种IgG1亚型的重组人源性IL-6受体单克隆抗体,可以阻止IL-6与IL-6受体结合,从而抑制IL-6受体和IL-6诱导的信号传导而发挥作用。托珠单抗推荐剂量为患儿体重≤30 kg,每次12 mg/kg;患儿体重>30 kg,每次8 mg/kg,每2周1次,静脉滴注。
TNFα抑制剂包括依那西普、英夫利西单抗、阿达木单抗。最典型的TNFα抑制剂是依那西普,其是第一个应用于儿童的TNFα抑制剂,是TNFα受体P75与人IgG1 Fc段融合表达形成的蛋白,剂量为每次0.4 mg/kg,最大剂量为25 mg/次,每周2次,皮下注射。英夫利西单抗是人鼠嵌合抗TNFα IgGlK 同型链单克隆抗体,可与细胞膜表面TNFα结合,用法为3~5 mg/kg,缓慢静脉滴注,第1次注射后,第2次和第3次注射分别于第2周及第4周进行,后续用药间隔视病情而定。阿达木单抗是一种全人源化的TNFα 单克隆抗体,皮下注射给药,患儿体重<30 kg每次20 mg,患儿体重≥30 kg每次40 mg,每2周1次。
4. 国际指南及建议:2013年美国风湿病学会(ACR)对JIA的治疗建议指出[3],针对有活动性全身症状和不同程度滑膜炎的全身型JIA患儿,应用NSAIDs、DMARDs和激素效果不佳时可加用阿那白滞素,阿那白滞素治疗1个月病情控制欠佳时加用托珠单抗;受累关节数>4个的患儿可采用TNF抑制剂;对无活动性全身症状但有不同程度活动性滑膜炎的全身型JIA患儿,在免疫抑制剂治疗3个月后,疾病活动性仍未降低者可加用生物制剂。2018年德国全身型JIA专家共识提出[4],达标治疗及药物减停策略,即在停用激素后至少在达到临床非活动疾病状态,才开始考虑减量生物制剂。2018年日本全身型JIA诊疗流程中强调[5],在药物减停过程中要密切监测指标,防范MAS的发生。
五、预后
全身型JIA在严重度、病程、预后方面存在异质性,有三种表现形式:
(1)表现为单次发病,2~4年内病情缓解;
(2)反复复发,以全身症状伴轻度关节炎为特点;
(3)病情持续活动表现为发热和活动性关节炎持续存在。重症患儿可在任何时间以关节外症状出现疾病的复发,或尽管正规治疗仍表现为活动性关节炎直至成人期。
总之,全身型JIA预后较差,多数患儿会有长期的功能残疾。目前认为全身型JIA的病死率仍高于JIA的其他亚型。
六、诊疗要点
1.全身型JIA是儿童时期的一种以高炎症状态为特点的发热出疹性疾病,可伴有关节炎或关节痛,全身各系统和脏器均可受累。
2.全身型JIA是一种排除性诊断,无特异性诊断标准,诊断过程中需除外感染性疾病、血液系统恶性病及其他风湿性疾病等,临床上一直采用2001年ILAR提出并修订的JIA分型标准,2019年PRINTO提出的JIA新的分型标准强调了白细胞计数在全身型JIA诊断中的重要作用。
3.全身型JIA的治疗药物主要包括激素、DMARDs和生物制剂,根据病情严重及主要临床表现不同,酌情选择不同的药物。
4.全身型JIA的预后较JIA其他分型相对差。
少关节型和多关节型幼年特发性关节炎
少关节型是JIA最常见的亚型,约占JIA的27%~56%,多发生于女性患儿(女性∶男性为4∶1),发病高峰年龄<6岁。多关节型亦是JIA较为常见的亚型,约占JIA的18%~30%,其中RF阴性型更为多见,占JIA的11%~28%,发病年龄高峰为3.5岁左右及10~11岁;RF阳性型占JIA的2%~7%,多见于女性患儿。
少关节型和多关节型JIA虽在儿童风湿性疾病中属于常见病,但由于国内儿童风湿免疫专业发展较晚,国内同行对儿童风湿性疾病的诊治经验仍不足,本病规范化诊疗的普及依然欠缺,本文旨在规范少关节型和多关节型JIA的诊断分型和治疗方案,以降低致残率及严重并发症的发生率,改善患儿预后。
一、临床表现
(一)少关节型JIA
少关节型JIA在发病最初6个月内有1~4个关节受累。如果病程大于6个月关节受累数大于4个,定义为扩展型少关节型JIA;病程中受累关节≤4个,定义为持续型少关节型JIA。膝、踝、肘或腕等大关节为好发部位,常为非对称性。腕关节受累预示疾病可能进展为扩展型或多关节型,也预示病情相对较难控制。肩关节受累罕见。颈椎棘突受累可表现为斜颈。多数患儿以关节疼痛和晨僵为主诉。25%的患儿可无关节疼痛而仅有关节肿胀。虽然关节炎反复发作,但很少致残。
(二)多关节型JIA
本型起病隐匿,受累关节≥5个,呈对称性或非对称性分布,可同时累及大小关节。掌指/跖趾关节、近端指间关节和趾间关节等小关节受累较为常见。颈椎及颞颌关节常易累及。病初可能伴有低热,热型多为不规则型。RF阳性型患儿可发生Felty综合征(脾大伴白细胞减少)。约10%的患儿可出现类风湿结节,常见于肘关节和膝关节周围。本型关节症状较重,如不及时治疗约半数以上发生关节强直变形而影响关节功能。
(三)关节外表现
1. 虹膜睫状体炎:少关节型和多关节型JIA常见的关节外表现为虹膜睫状体炎,又名慢性葡萄膜炎。约20%~30%的患儿发生慢性虹膜睫状体炎而造成视力障碍甚至失明。部分患儿表现为眼睛发红、畏光、流泪等不适,但有部分患儿并无眼睛不适表现,仅在常规裂隙灯检查中发现。葡萄膜炎常见于抗核抗体阳性的少关节型和多关节型JIA患儿。
2. 肺部损害:多关节型JIA可出现肺部病变,其中最常见的是间质性肺炎,严重者可出现间质性纤维化,此外还可出现胸膜炎、肺部类风湿结节、闭塞性细支气管炎、肺血管病变和肺动脉高压。
3. 肝脾和淋巴结肿大:严重的少关节型和多关节型JIA可出现肝脾和淋巴结肿大,经治疗可好转。
二、辅助检查
1.血常规和CRP:多数少关节型JIA患儿血常规和CRP正常,仅少数患儿出现白细胞计数、血小板计数和CRP轻度升高,出现轻度贫血;多关节型JIA患儿可出现白细胞计数、血小板计数和CRP中重度升高等炎症表现,亦可出现轻中度贫血。
2.ESR:少关节型JIA患儿ESR基本正常,ESR增快预示疾病可进展为扩展型JIA。多关节型JIA患儿可出现ESR中重度增快,尤其RF阳性的多关节型患儿更为突出。
3.自身抗体:约50%~70%的少关节型患儿抗核抗体可呈阳性,滴度在1∶40~1∶320。约25%的多关节型患儿抗核抗体可呈阳性,在幼年发病的女孩中ANA阳性出现的频率更高。
4.RF和抗环瓜氨酸多肽(CCP)抗体:RF阳性的多关节型患儿抗CCP抗体阳性率约为48%,RF和抗CCP抗体阳性预示着关节损害重,另外RF阳性患儿可能合并肺损害。
5.影像学检查:X线早期显示关节附近软组织肿胀,关节腔增宽,近关节处骨质疏松,指、趾关节常有骨膜下新骨形成;后期关节面骨质破坏,以腕关节多见,骨骺早期关闭,骺线过度增长,关节腔变窄甚至消失。受累关节易发生半脱位。其他影像学检查如关节超声和MRI均有助于了解关节腔积液、骨髓水肿和骨质破坏的情况。
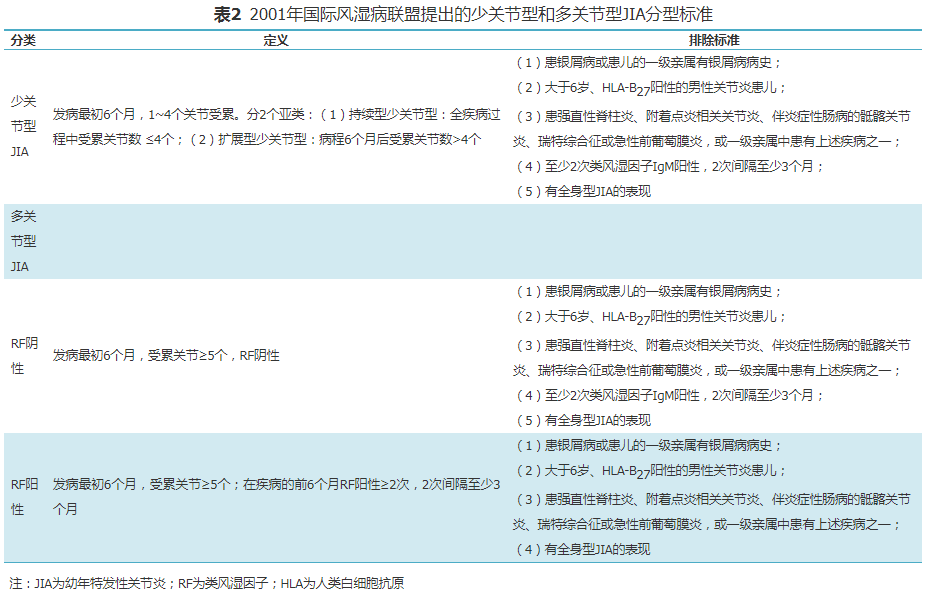
三、分型标准
少关节型和多关节型JIA目前仍采用2001年ILAR提出并修订的JIA分型标准,见表2。
JIA是一类排除性疾病,诊断时需除外其他可能的疾病:
1.其他型JIA:如ERA和PsA,应结合详细病史进行鉴别。
2.其他结缔组织病:如系统性红斑狼疮和幼年皮肌炎等疾病引起的关节炎,应询问病史中有无皮疹和肌无力等表现,结合自身抗体、脏器相关的辅助检查来明确。
3.感染性关节炎:如化脓性关节炎、结核性关节炎、布氏杆菌病等,结合临床表现和病原学检测结果进行鉴别。
4.血液系统恶性病:如急性白血病、淋巴瘤、恶性组织细胞病等,通过影像学检查和活组织检查如骨髓细胞学检查、淋巴结和局部病灶活组织检查进行鉴别诊断。
5.其他:如色素沉着绒毛结节性滑膜炎、动静脉畸形、出凝血障碍(如血友病)及严重创伤。
四、治疗方案及原则
本病的治疗原则:控制病变的活动度,减轻或消除关节疼痛和肿胀;预防感染和关节炎症的加重;预防关节功能不全和残疾;恢复患儿的关节功能及生活与劳动能力。
(一)一般治疗
保证患儿适当休息和足够的营养。鼓励患儿参加适当的运动,尽可能像健康儿童一样生活。采用医疗体育、理疗等措施可防止关节强直和软组织挛缩。此外,心理治疗亦很重要,应克服患儿因患慢性疾病或残疾而造成的自卑心理,增强自信心,使其身心得以健康成长。
(二)药物治疗
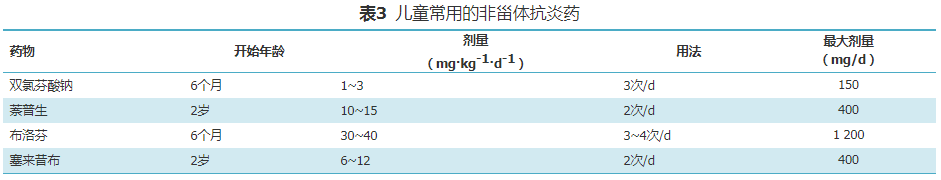
1.NSAIDs:儿童常用的NSAIDs见表3。
2.激素:虽可减轻JIA患儿的关节炎症状,但不能阻止关节破坏,故无论全身或关节局部给药均不作为首选或单独使用,应严格掌握指征。
(1)少关节型JIA:不主张用激素全身治疗,大关节如膝关节大量积液的患儿,除用其他药物治疗外,可在关节腔内抽液后,注入复方倍他米松或地塞米松,能缓解疼痛,防止再出现关节积液,并有利于恢复关节功能。
(2)多关节型JIA:对NSAIDs和DMARDs未能控制病情或炎症反应较剧烈的患儿,加用小剂量泼尼松口服,0.5~1 mg·kg-1·d-1(每日总量≤60 mg)。
(3)虹膜睫状体炎:轻者可用扩瞳剂及激素类眼药水点眼。对严重影响视力的患儿,除局部注射激素外,需加用口服泼尼松。虹膜睫状体炎对泼尼松很敏感,剂量一般不宜过大。
3. DMARDs
(1)羟氯喹:剂量为5~6 mg·kg-1·d-1,总量不超过0.25 g/d,分1~2次服用,疗程3个月~1年。不良反应可有视网膜炎、白细胞计数减少、肌无力和肝功能损害。
(2)柳氮磺吡啶:剂量为30~50 mg·kg-1·d-1,服药1~2个月即可起效。副作用包括恶心、呕吐、皮疹、哮喘、贫血、骨髓抑制、中毒性肝炎和不育症等。
(3)甲氨蝶呤:剂量为10~15 mg/m2,每周1次顿服,服药3~12周即可起效。甲氨蝶呤不良反应较轻,有不同程度胃肠道反应、一过性转氨酶升高、胃炎和口腔溃疡、贫血和粒细胞减少等。长期使用增加发生肿瘤的风险。
(4)来氟米特:用于年龄偏大的患儿,剂量为10~15 mg/d,常见的副反应是腹泻、转氨酶升高、脱发、皮疹、白细胞计数下降和瘙痒等。
(5)环孢素A:可单用,亦可与甲氨蝶呤配合使用,常用剂量为3~5 mg·kg-1·d-1。副反应包括齿龈增生、多毛症、肾功能不全和高血压。
(6)环磷酰胺:可用于合并严重肺间质病变的多关节型JIA患儿,应用剂量每次300~400 mg/m2,每月1次,可配合其他免疫抑制剂,但需要注意药物副作用,尤其肝功能损害和骨髓抑制。
4. 生物制剂:用于治疗JIA效果良好。可能的风险包括结核感染、其他机会致病菌感染、肝炎及肿瘤的发生等,治疗前需常规行结核菌素(PPD)试验、胸片和肝炎病毒抗体检测等。目前常用于少关节型和多关节型JIA的生物制剂如下:
(1)TNF抑制剂:TNF受体抗体融合蛋白适用于关节症状较明显的患儿,每次0.4 mg/kg,每周2次皮下注射。患儿经传统的标准治疗后反应不佳或不能耐受传统治疗,且处于病情活动期为英夫利西单抗治疗的适应证,每次3~5 mg/kg,缓慢静脉滴注,第1次注射后,第2次和第3次注射分别于第2周及第4周进行,后续用药间隔视病情而定。英夫利西单抗治疗可达很好的临床疗效,并可抑制影像学进展,但该药为静脉使用,可能引起1%的患儿发生严重过敏反应。另外,反复用药后可能产生抗英夫利西单抗抗体,同时应用甲氨蝶呤可减少抗体产生。阿达木单抗已被国家药品监督管理局(NMPA)批准用于治疗≥4岁的多关节型JIA,患儿体重<30 kg时20 mg/次,患儿体重≥30 kg时40 mg/次,每2周1次皮下注射。
(2)IL-6抑制剂:托珠单抗用于难治性全身型JIA有较好的疗效,静脉滴注,每次8~12 mg/kg,每2周1次。目前有研究认为,托珠单抗用于难治性多关节型JIA患儿可有效改善症状和体征。不良反应可能增加感染风险,其他如胃肠道症状、皮疹和头疼等。
(3)阿巴西普:是可溶性融合蛋白,可调节CD80CD28/CD86CD28 T细胞共刺激信号通路的激活,对多关节型JIA有效,每次10 mg/kg,静脉滴注,第1次治疗后,第2次和第3次治疗分别于第2周及第4周进行,之后每4周接受1次治疗。
5.小分子靶向药:国外的JIA临床研究数据表明,Janus激酶(JAK)抑制剂用于治疗JIA的安全性比较可靠,且对疾病活动度、身体机能和ACR应答率均有所改善。
6.中成药:白芍总甙作为免疫调节剂可用于治疗JIA,有助于改善关节症状,同时亦有保护肝功能的作用。
(三)少关节型JIA治疗方案
治疗方案仍采用2011年ACR提出的关于少关节型JIA的治疗指南。若对单一NSAIDs治疗效果不佳或关节腔注射耐药,应考虑加用DMARDs如甲氨蝶呤或TNFα拮抗剂。
(四)多关节型JIA治疗方案
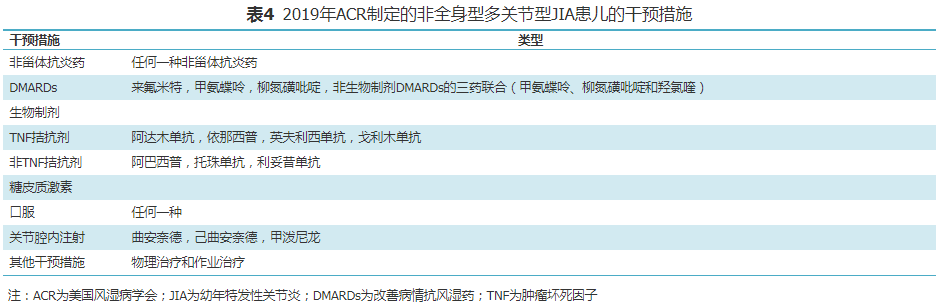
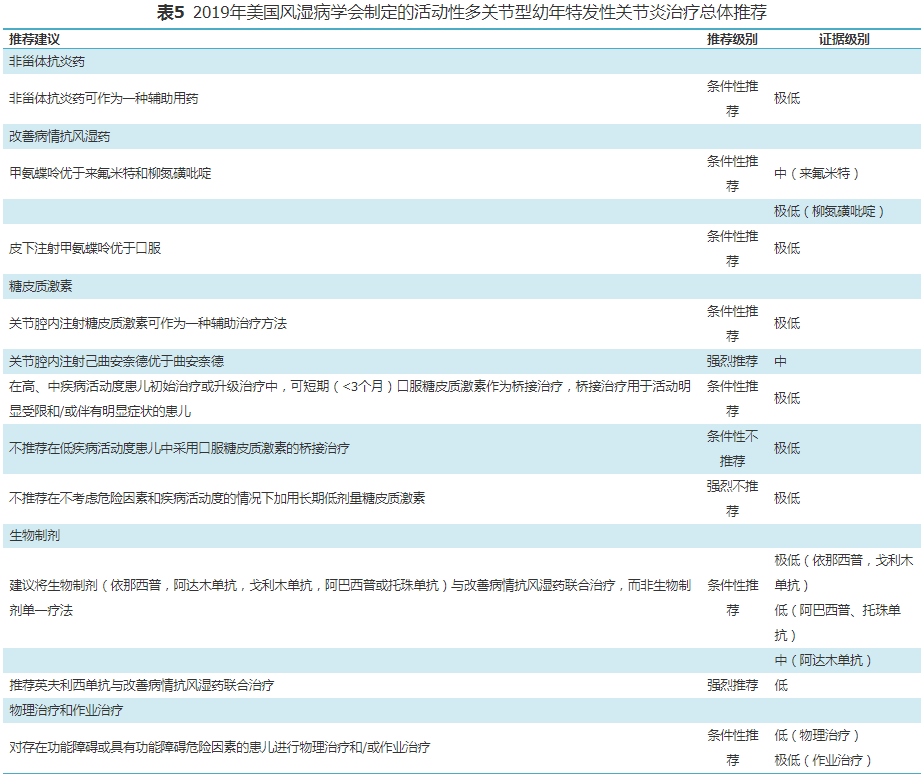
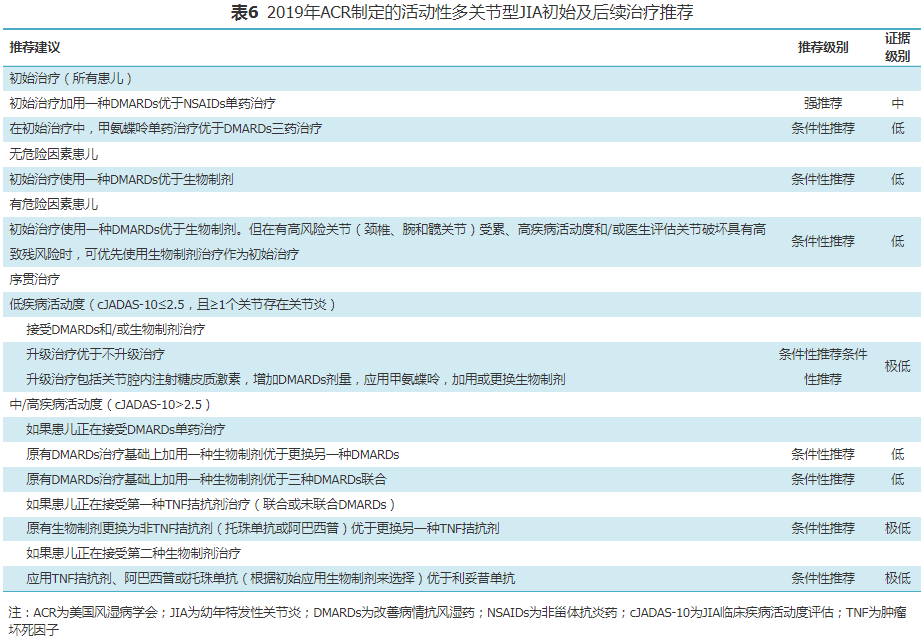
2019年ACR结合最新发表的相关数据,根据循证医学推荐意见分级的评估、制定及评价(GRADE)方法提出了关于非全身型多关节型JIA患儿的治疗指南[6],其中的药物和非药物干预措施见表4。激素的桥接治疗定义为短期疗程(<3个月)口服激素,旨在dmards升级或生物制剂治疗初期快速控制疾病活动度,使用最短的持续时间和最低的剂量来控制症状。桥接治疗的持续时间主要由其他dmards或生物制剂治疗的起效时间来确定。甲氨蝶呤的试验性用药时间是3个月。指南中将存在下述一种或一种以上因素时认为存在危险因素,rf阳性,抗ccp抗体阳性,关节破坏。jia临床疾病活动度评估>2.5为中、高疾病活动度;JIA临床疾病活动度评估≤2.5,且≥1个关节存在关节炎(关节肿胀,或关节活动受限伴疼痛和/或压痛)为低疾病活动度。针对非全身型多关节炎JIA患儿治疗的总体建议中提出了关于NSAIDs、DMARDs、关节腔内注射激素和生物制剂的应用建议,具体推荐内容见表5和表6。
五、预后
大多数少关节型JIA患儿预后良好,但部分患儿病情易反复。最坏的预后是视力丧失,尤其在早期即有明显的眼睛受累。其他后遗症包括双下肢不等长,其他关节受累,如颞下颌关节。约30%的多关节型JIA患儿可达到长期缓解,对称性关节及早期手部关节受累的患儿容易远期致残及预后较差。此类患儿最终身高受限,但较全身型患儿预后稍好。
六、诊疗要点
1.少关节型和多关节型JIA是儿童风湿病中的常见病,除关节受累外,还可出现关节外表现,最常见的是虹膜睫状体炎和间质性肺炎。
2.治疗药物包括NSAIDs、激素、DMARDs、生物制剂和小分子靶向药,依据受累关节的部位、数量,结合RF和抗CCP抗体等重要实验室指标,遵循2011年和2019年ACR制定的JIA指南推荐进行治疗。
3.大多数少关节型和多关节型JIA预后良好,但需早期诊断并积极治疗。
幼年脊柱关节炎
SpA是一组遗传异质性疾病,以关节炎、附着点炎及HLA-B27相关的遗传易感性基础上中轴关节受累为特点,包括强直性脊柱炎、PsA、反应性关节炎、炎性肠病性关节炎和未分化SpA。SpA可在儿童期起病,并延续到成人阶段,幼年SpA因此得名,是指16岁前发生的SpA[7]。
随着2001年ILAR提出JIA分类标准的广泛推广应用,幼年SpA的名称逐渐被取代,并归类于ERA、PsA和未分化关节炎。但关于使用ILAR分类或幼年SpA来定义这一组疾病一直在广泛讨论,且新的命名未将炎性肠病性关节炎及反应性关节炎囊括其中。
2019年PRINTO关于JIA新诊断标准中,再次提出了附着点炎/SpA相关JIA的概念,定义为外周关节炎和附着点炎,或关节炎/附着点炎,加炎性腰背痛≥3个月,伴影像学发现骶髂关节炎,或关节炎或附着点炎加下述条件中的2项:
(1)骶髂关节压痛;
(2)炎性腰背痛;
(3)HLA-B27阳性;
(4)急性(症状)前葡萄膜炎;
(5)一级亲属SpA家族史;
(6)男性大于6岁出现关节炎。
这一新标准尚未得到广泛认可,故本文仍使用ILAR的JIA分类标准对SpA类疾病的诊疗规范进行阐述。
幼年SpA在我国的患病率尚不明确,国外资料对其患病率的估计也源于JIA的数据,全世界JIA的患病率为(7~400)/10万,其中ERA和PsA占 2%~11%,约为每10万儿童0.28~88例。
我国幼年SpA并不少见,但其规范化诊疗的普及依然欠缺,本文旨在规范幼年SpA的诊断方法、治疗时机及治疗方案,减少误诊和漏诊,以减少不可逆损伤的发生,改善患儿预后。
一、概述
根据ILAR诊断标准,ERA是以肌腱附着点炎为主要特征,附着点又称起止点,是指韧带、肌腱、关节囊或筋膜与骨骼连接的部位,附着点炎症是指在附着点部位出现疼痛、肿胀及压痛。
国内外的资料均表明,本病男性多发,男∶女为6~9∶1,以8~15岁儿童起病多见。PsA是指一种影响皮肤和关节,并有相关关节外表现及合并症的免疫炎性疾病,患儿兼有关节炎和银屑病,无银屑病表现者需兼具下述至少两条:指(趾)炎、指甲凹陷(任何时间至少在一个或更多指甲上有2个凹面)或甲脱离、一级亲属有银屑病史。
未分化关节炎是指不完全符合任何一型关节炎的诊断标准或剔除标准,或同时符合一型以上关节炎诊断标准。
未分化关节炎中属于幼年SpA范畴的类型是指同时符合附着点炎和PsA特点的关节炎。
未分化关节炎占JIA的1%~2%。
二、临床表现
幼年SpA主要的症状是附着点炎,关节炎通常不对称,少关节,累及下肢大关节,可出现跗骨炎(足中部炎症)和髋关节炎,与成人比,儿童的外周关节受累多见,中轴关节受累少见,腰背痛很少见,腰背痛对SpA的预测价值较低。
据报道,确诊幼年SpA后未干预的患儿可在15个月发展为中轴关节炎,10年后2/3患儿可发展为中轴关节炎。部分患儿可能逐渐进展为具有成人强直性脊柱炎典型特点的骶髂关节炎和脊柱炎。儿童骶髂关节炎和髋关节炎均是活动关节炎的表现,幼年SpA的共同表现还包括男性多见、下肢关节炎、肌腱附着性炎、肠道炎症、脊柱和骶髂关节炎症、症状性前葡萄膜炎、银屑病、指趾炎、可存在HLA-B27阳性。部分患儿会出现关节外症状。不同亚型的关节炎临床表现又有所不同。
1. 附着点炎相关关节炎:附着点炎的好发部位包括足跟、跟腱、足背、足底、坐骨结节、胫骨粗隆、胸锁关节、骶髂关节和脊椎棘突等,表现为相应部位的疼痛和/或肿胀。关节炎以髋关节、膝关节、踝关节为著。表现为关节肿痛和活动受限,部分患儿有夜间痛,体检可见受累关节肿胀、触痛、活动受限。部分患儿可能逐渐进展为具有成人强直性脊柱炎典型特点的骶髂关节炎和脊柱炎。骶髂关节病变可于起病时发生,但多数于起病数月至数年后才出现,典型症状为下腰部疼痛,初为间歇性,数月或数年后转为持续性,疼痛可放射至臀部,甚至大腿,体检可有骶髂关节压痛,“4”字征阳性。
随病情进展,腰椎受累时可致腰部活动受限,向前弯腰时腰部平直。严重者病变可波及胸椎和颈椎,使整个脊柱呈强直状态。当胸椎受累时胸廓扩展受限,测定腰部前屈活动的方法为Schober试验,在髂后上棘连线中点与垂直向上10 cm处及向下5 cm处各作一标志,测定腰部前屈时两点间的距离,健康人前屈时此两点间距可长达至20 cm以上(即增加5 cm以上)。
ERA可伴急性前葡萄膜炎,表现为急性红眼、眼痛,还可有全身症状如低热、乏力、食欲低下、消瘦等。
2. PsA:患儿兼有关节炎和银屑病,无银屑病表现者会有指(趾)炎、指甲异常、一级亲属有银屑病史。远端指(趾)间关节受累是PsA的特征性表现,早期累及手关节较足关节多见。临床表现为关节疼痛、红肿、晨僵,进一步发展可出现不同程度的功能障碍,甚至发生残毁。关节炎多为非对称性分布,大小关节均可受累(大关节通常为膝关节和踝关节),典型症状为指趾炎,足趾较手指更为显著。少数可累及骶髂关节及脊柱。根据发病部位可将PsA分为外周关节炎型和中轴(脊柱)关节炎型,部分患儿可以外周和脊柱同时受累。15%的PsA患儿可发生葡萄膜炎。本病有强烈的遗传倾向。
银屑病皮肤损害是PsA与类风湿关节炎(RA)等炎症性关节病的重要区别,另外,指(趾)甲改变是PsA的重要特征,80%患儿有指(趾)甲病变,表现为甲床、甲基质病变,前者包括甲分离、甲下角化过度、裂片状出血和油斑改变,甲基质受累的特征性表现有点状凹陷、白甲、甲半月红斑和甲破碎。甲受累患儿出现关节受累的比例为43%~70%,是PsA最强的预测因素。
三、辅助检查
1.ERA:80%~90%的ERA患儿可检测到HLA-B27,并有助于明确诊断,但ERA目前尚无特异性实验室检查手段。ESR可轻度或显著增快,可伴轻度贫血。约13%的ERA 患儿RF阳性,且阳性率随年龄的增长而增加;约5%的ERA 患儿抗CCP抗体阳性。ANA可阳性。超声检查可鉴别附着点炎。早期骶髂关节炎X线表现有时很难确定,CT、MRI分辨率高,有利于发现骶髂关节轻微的变化,适于骶髂关节炎的早期诊断。
2.PsA:PsA患儿的ESR、CRP、血小板计数可能轻度升高,可有轻度贫血。约50%的患儿ANA阳性。RF检测为阴性。影像学检查早期PsA以骨髓水肿和附着点炎、腱鞘滑膜炎、滑囊炎、软组织水肿为主要表现,进展期或残毁型关节炎以骨质侵蚀、骨赘、骨桥形成或韧带钙化、关节畸形为主要表现。对SpA型PsA,建议选择 MRI进行骶髂关节和脊柱检查;外周关节炎型PsA,可选择X线、超声和/或MRI检查;超声和MRI更有助于附着点炎、指(趾)炎等炎症性病变的发现和评估。
四、诊断
ILAR制定的PsA、附着点炎相关关节炎、未分化关节炎的诊断标准见表7。

五、治疗
治疗目的在于控制炎症,缓解疼痛,保持良好的姿势和关节功能。患儿宜睡木板床或硬床垫,避免睡高枕。加强功能锻炼及体育活动、以改善姿势和增强腰肌力量。
药物治疗:NSAIDs中的双氯芬酸较常用,对减轻疼痛、缓解关节肿胀有较好的作用。若患儿胃肠道对NSAIDs难以耐受,可选用环氧化酶2抑制剂(塞来昔布)。DMARDs包括甲氨蝶呤、柳氮磺吡啶等。炎症明显者可短期加用口服激素。生物制剂包括TNF拮抗剂,如依那西普或阿达木单抗等。在2019年ACR对本病的诊疗建议中,强烈推荐早期加用TNFα抑制剂。新近的研究表明,IL-17拮抗剂司库奇尤单抗在成人SpA患者中已得到肯定疗效,在儿童的应用尚在研究中。IL-12/23拮抗剂乌司奴单抗在儿童SpA的治疗中亦有较好的应用前景。
治疗药物的选择主要是根据疾病活动关节数及是否出现骶髂关节炎决定,推荐4个以下的疾病活动关节可用NSAIDs和甲氨蝶呤,可加用关节腔注射;5个以上的疾病活动关节,将NSAIDs和甲氨蝶呤作为初始治疗,合并骶髂关节炎的患儿建议加用生物制剂治疗。对合并肠病、葡萄膜炎患儿,单抗类TNFα抑制剂优于受体融合蛋白类TNFα抑制剂。
PsA的治疗与少关节型JIA的治疗相似;局限性关节受累的患儿对关节腔内注射激素反应较好。甲氨蝶呤对银屑病皮肤及关节损害有效。对难治性PsA患儿,建议应用TNFα拮抗剂,可显著减少骨破坏。通常不选用口服激素。
六、预后
据文献报道,约20%的幼年SpA患儿在治疗5年后达到临床缓解,引起幼年SpA不良预后的因素包括体重指数增加、踝关节炎、髋关节炎、骶髂炎、HLA-B27阳性。
七、诊疗要点
1.幼年SpA的主要症状是附着点炎,关节炎通常不对称,少关节,累及下肢大关节,可出现跗骨炎(足中部炎症)和髋关节炎,与成人比,儿童的外周关节受累多见,中轴关节受累少见,腰背痛很少见。
2.诊断标准参照ILAR对附着点炎相关关节炎、PsA和未分化关节炎的诊断标准。
3.治疗目的在于控制炎症,缓解疼痛,保持良好的姿势和关节功能。选择治疗药物主要根据疾病活动关节数及是否出现骶髂关节炎决定。
4.引起幼年SpA不良预后的因素包括体重指数增加,踝关节炎,髋关节炎,骶髂炎及HLA-B27阳性。
全身型幼年特发性关节炎合并巨噬细胞活化综合征
MAS是一种有潜在生命危险的风湿性疾病严重并发症,可并发于各种风湿性疾病,但最常并发于全身型JIA。引起MAS的原因目前尚不清楚,可能与患儿自身免疫细胞功能紊乱有关。
MAS的发病机制亦未完全明确,T淋巴细胞和分化完好的巨噬细胞的增生与过度活化是MAS 的发病基础,其持续的过度增生可造成细胞因子如TNFα、IL-1、IL-6短期内瀑布样释放,进而出现MAS的临床特征和实验室检查指标的变化。
此外,遗传背景和炎症反应在本病的发生中亦发挥重要作用。全身型JIA患儿中MAS的患病率约为10%,而亚临床MAS患儿比率则可达40%。有报道显示,全身型JIA并发的MAS的病死率约8%~22%。
我国全身型JIA合并MAS的患病率虽然不高,但该病由于早期临床症状不典型,漏诊及误诊率高,规范化诊疗的普及依然欠缺,本文旨在规范儿童风湿病继发MAS的诊断方法、治疗时机及治疗方案,以减少误诊和漏诊;对患儿的短期与长期治疗及护理方案给予建议,以降低严重并发症的发生率,改善患儿预后。
一、临床表现
(一)病程
全身型JIA是一种异质性疾病,起病时全身非特异性症状突出,以高炎症状态为主;可能缺乏典型关节炎及“热出疹出、热退疹退”的临床特点,后期可能出现上述临床表现伴或不伴骨侵蚀的影像学改变。该病的自然病程表现为三种形式,单峰型、多峰型及持续进展型,其中单峰型临床表现异质性最为显著,具有自限性,临床误诊和漏诊率最高。
(二)症状
1.发热:持续高热常常是MAS的首发症状,稽留热为主要表现形式,但亦有表现为全身型JIA高活动性时的弛张热。
2.皮疹:持续不退的充血性“荨麻疹”样皮疹,是该病急性起病期的主要表现之一,多与发热并行,是全身高炎症反应、血管炎表现的重要特点之一。少数患儿皮疹可融合成片,不易消退,重症病例可表现为“红皮病”样皮疹或斯-琼综合征(Stevens-Johnson syndrome,SJS)。进展期MAS患儿皮肤黏膜易出血,可表现为紫癜、易损伤、黏膜出血、消化道出血,亦可能出现弥散性血管内凝血(DIC)。
3.肝脾及淋巴结肿大:肿大程度不同;肝功能急剧恶化,可表现为恶心、呕吐、黄疸及肝酶在短期内迅速升高,并可出现肝脏其他代谢功能紊乱。
4.中枢神经系统功能障碍:可有嗜睡、烦躁、定向力障碍、头痛、抽搐、昏迷,重症患儿可出现脑疝。
5.合并多系统损害及脏器功能异常:可出现心功能不全、血压下降;肾功能损害、肝功能异常、高胆红素血症等,合并肺脏损害时,重症可出现急性呼吸窘迫综合征(ARDS)、呼吸衰竭表现。
该病临床表现差异很大,可非常严重,由于脑、心脏、呼吸及肾脏等多脏器功能衰竭而危及生命,亦可仅表现为持续发热,不伴有显著多系统受累,病程可迁延反复。
二、实验室检查
1.末梢血细胞减低:可表现为白细胞计数减低,贫血,血小板计数减低,累及血细胞一系或三系。
2.血清肝酶增高:丙氨酸转氨酶、天冬氨酸转氨酶、谷氨酰转肽酶等均可增高,以天冬氨酸转氨酶升高更明显,其特点为短期快速增高,可出现于数小时内;部分患儿可出现总胆红素升高,以直接胆红素升高为主。
3.凝血功能异常:可有凝血酶原时间、活化部分凝血活酶时间延长,纤维蛋白原降低,纤维蛋白(原)增加,D-二聚体增高。
4.血生化的改变:可有甘油三酯、乳酸脱氢酶增高,尤其乳酸脱氢酶升高迅速且程度较重;其他肌酶也可不同程度增高;钠离子、白蛋白减低。
5.ESR可迅速降低:这可能由血液纤维蛋白原降低所致,与全身高炎症状态不匹配。
6.血清铁蛋白增高:是本病特点之一,增高程度往往达数千甚至上万,大量研究结果表明,血清铁蛋白增高可作为评价MAS病情活动性的指标。
7.组织病理学特征:可以在骨髓穿刺活检、淋巴结活检或肝脾活检时发现分化完好且极度增生活跃的嗜血细胞。但并不是所有患儿均可发现,尤其在疾病早期。骨髓细胞学检查早期可表现为反应性组织细胞增生,后期出现可吞噬红细胞、血小板、有核细胞的噬血细胞。骨髓细胞学检查虽然不是诊断的必备条件,但如果发现嗜血细胞,则对诊断有非常重要的意义。
三、影像学检查
MAS的影像学改变取决于脏器受累程度和范围,需结合病例特点综合考虑。如出现心脏电生理异常,心脏血流动力学改变,头颅MRI可能出现脑水肿或脑疝,肺部影像学改变以肺水肿、通气及含气不良为主要改变等,需严格与该系统原发性疾病影像学改变相鉴别。
四、诊断与鉴别诊断
MAS是一种威胁生命的并发症,故早期诊断及快速和有效的治疗是抢救生命的关键。MAS的诊断既往参考2002年和2005年的Ravelli诊疗方案[8]。
2016年欧洲抗风湿病联盟/ACR和儿科风湿病国际试验组织提出了全身型JIA合并MAS的分类标准[9],目前临床主要参考2016年MAS的诊断标准:
(1)铁蛋白>684 ng/ml;
(2)血小板计数≤181×109/L;
(3)天冬氨酸转氨酶>48 U/L;
(4)甘油三酯>1.76 mmol/L(156 mg/dl);
(5)纤维蛋白原≤ 3.6 g/L。
诊断条件:确诊或疑似全身型JIA的发热患儿,符合上述条件可诊断为MAS,第1条为必备条件,第2条~第5条满足任意2条或2条以上(实验室指标异常需除外免疫性血小板减少、传染性肝炎、内脏利什曼病或家族性高脂血症等疾病)。
五、治疗
MAS是儿童风湿免疫性疾病的一种危重并发症,有报道病死率达8%~22%,早期诊断、积极治疗可极大改善预后。
全身型JIA合并MAS时应根据系统症状的严重程度、疾病活动性、预后不良因素及有无并发MAS,基于治疗安全性、有效性、耐受性、依从性,制定个体化治疗方案。
一般治疗包括卧床休息、避免感染,合理制定饮食结构,避免或减少接触致敏原。同时注意液体摄入量和滴速,必要时予抗感染、对症支持治疗。在稳定内环境基础上加强原发病的药物治疗。
目前常用的药物治疗方案:
1. NSAIDs:有助控制发热等全身症状、减轻关节疼痛和炎症。常用NSAID包括布洛芬,30~40 mg·kg-1·d-1,分3~4次口服,用于6个月以上儿童;双氯芬酸,1~3 mg·kg-1·d-1,分3次口服,用于6个月以上儿童;萘普生,10~15 mg·kg-1·d-1,分2次口服,用于2 岁以上儿童。应注意不能同时服用2种及以上NSAIDs。NSAIDs不能阻止关节病变进展,不建议长期使用,并关注其肝肾毒性作用,少数患儿可能因不当应用NSAIDs诱发或加重MAS(NSAIDs具体治疗方案参见“全身型JIA”)。
2. 激素:静脉应用激素是治疗MAS的首选治疗方法,常常需大剂量甲泼尼龙冲击治疗,剂量为30 mg·kg-1·d-1,一般最大剂量为1 g/d,连用3~5 d后改为口服。足量口服剂量为2 mg·kg-1·d-1,全天最大剂量为泼尼松60 mg,甲泼尼龙48 mg,足量激素治疗有效,足疗程口服时间一般不超过4~6周。如病情需要,可重复应用大剂量甲泼尼龙冲击,控制炎症反应,减少全身性大量口服激素对患儿的副作用。
大剂量甲泼尼龙冲击时可能造成心脏传导功能异常、血压增高、高眼压等,需要在治疗过程中监测生命体征。
3. 环孢素A:激素耐药者要应用环孢素A治疗。有报道,环孢素A治疗重症MAS,有的患儿在12~24 h出现明显的临床及实验室检查指标的改善。其通过抑制巨噬细胞和T细胞而达到治疗MAS的有效作用,故亦有学者将其定为治疗MAS的一线药物。常用剂量为2~8 mg·kg-1·d-1,急性期以静脉用药为佳,一旦病情控制,即改为口服治疗,应用本药时需监测血药浓度。
4. 生物制剂:生物制剂是全身型JIA治疗的重要药物,以IL-1受体拮抗剂(阿那白滞素)和IL-6受体拮抗剂(托珠单抗)为主,早期、合理使用生物制剂有助于减停激素。因国内尚无IL-1受体阻断剂上市,目前主要使用IL-6受体阻断剂(托珠单抗)。针对全身炎症反应轻、关节炎为主的全身型JIA患儿亦可选择使用TNFα拮抗剂。2013年ACR提出全身型JIA合并MAS的首选治疗是激素、钙调磷酸酶抑制和生物制剂阿那白滞素。针对恢复期患儿,若存在激素减量困难和/或高活动度关节炎时,可参考全身型JIA生物制剂的治疗方案。
5. 其他治疗:其他治疗还有静脉输注免疫球蛋白(IVIG),应用依托泊苷及血浆置换,但报道较少,作用尚不确定。
六、预后
全身型JIA合并MAS的预后,关键取决于早期治疗的时机,及时有效的病情活动性监测,是减少重症及死亡的主要影响因素。合并MAS的患儿,治疗达标率低于单一全身型JIA。对有活动性全身表现的全身型JIA需每周进行疗效评估;对病情好转但全身炎症反应较重的患儿,至少每半个月随访1次;疾病控制达缓解状态后评估频率可4~6周不等。达到治疗目标后,尝试减少治疗频次或剂量,直至停药。规律随诊,动态评估病情变化,调整治疗方案,精细化、个体化治疗方案在慢性病管理方面很重要。应加强对全身型JIA患儿的长期管理,针对满18岁者,建议将就诊信息转至成人风湿专科医院。
七、诊疗要点
1.MAS是一种有潜在生命危险的风湿性疾病严重并发症,可并发于各种风湿性疾病,但最常并发于全身型JIA。
2.弛张高热或稽留热,伴持续性风团样皮疹,是最常见的临床表现。此外,合并肝、脾、淋巴结肿大,脑、心脏、呼吸及肾脏等多脏器功能损害是活动期MAS突出的临床表现。
3.实验室检查主要为铁蛋白、甘油三酯、天冬氨酸转氨酶升高;血小板计数及纤维蛋白原下降;其中铁蛋白升高为必备条件,满足其他2条或2条以上实验室指标可诊断MAS。
4.诊断标准经历了从2002年至2016年欧洲抗风湿病联盟/ACR/PRINTO制定的MAS分类标准变迁,需除外其他导致噬血细胞综合征的疾病,在诊断全身型JIA及其他风湿病基础上伴相应实验室指标异常,可确诊MAS。
5.确诊MAS后应依据临床及实验室表现,评估疾病活动性及脏器受累程度。
6.根据上述评估结果,选择全身性治疗及随诊评估方案,及时调整治疗。
7.早期识别、早期诊断、早期治疗,及时进行阶段性评估,调整治疗方案,可明显改善MAS的预后。
执笔者:
黄新翔(广西医学科学院 广西壮族自治区人民医院风湿免疫科);
张俊梅(国家儿童医学中心 首都医科大学附属北京儿童医院风湿免疫科);
邓江红(国家儿童医学中心 首都医科大学附属北京儿童医院风湿免疫科);
檀晓华(国家儿童医学中心 首都医科大学附属北京儿童医院风湿免疫科)
内容来源: 中华内科杂志