三生国健重组抗IL-4Rα人源化单克隆抗体注射液(611)临床试验,评价611治疗中重度特应性皮炎的II期临床试验
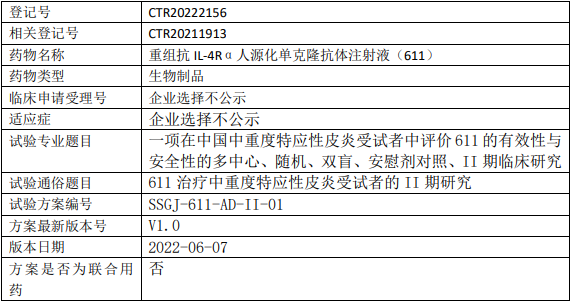
试验目的
主要目的
评价611治疗中重度特应性皮炎受试者的有效性与安全性;
次要目的
评价611在中重度特应性皮炎受试者的免疫原性、PK特征和PD特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.能够理解并遵循方案要求,自愿参加试验并签署书面知情同意书(ICF);
2.签署ICF时年龄在18~75周岁(含),性别不限;
3.筛选时根据2014年美国皮肤病学会共识标准诊断为AD,且经研究者评估其AD病史≥1年;
4.筛选和基线时,湿疹面积和严重程度指数(EASI)评分≥16分;
5.筛选和基线时,IGA评分≥3分;
6.筛选和基线时,AD受累体表面积(BSA)≥10%;
7.基线时,瘙痒数值评定量表(NRS)的周平均值≥4分;
8.筛选前1年内有相关病历记录或其他就诊记录或其他证据可供研究者评估,受试者外用药物治疗效果不佳,或者从医学上不适宜使用外用药物治疗;
9.愿意在随机前≥7天,每天2次在AD受累部位使用稳定剂量的润肤剂(保湿霜),并在研究期间持续使用;
10.育龄女性受试者(及其男性伴侣)以及男性受试者(及其女性伴侣)必须在整个研究期间及末次用药后至少3个月内采取高效的避孕措施。受试者在整个研究期间及末次用药后至少3个月内无生育、捐精、捐卵计划。
排除标准
1.合并可能干扰研究评估的其他皮肤合并症;
2.合并活动性寄生虫感染(如蠕虫)或疑似寄生虫感染;
3.任何春季角膜结膜炎(VKC)和特应性角膜结膜炎(AKC)病史;
4.随机前5年内或现患任何恶性肿瘤;
5.随机前2周内,患有需进行全身性抗感染治疗的活动性感染性疾病;或随机前1周内,患有需使用外用抗感染药物的皮肤感染;
6.已知或怀疑有免疫抑制病史,包括侵袭性机会感染病史;或尽管感染已消失但经研究者评估可能频繁发作者;
7.根据QuantiFERON-TBGold试验或T-SPOT.TB试验结果、临床症状和/或胸部影像学检查结果,判断受试者可能存在活动性结核分枝杆菌(TB)感染;
8.研究者认为存在严重的或不稳定的,且可能影响受试者在研究期间的安全性和/或妨碍受试者完成研究的任何疾病,包括但不限于心血管、胃肠、肝、肾、神经、肌肉骨骼、感染、内分泌、代谢、血液学、精神疾病,或筛选时经研究者评估具有自杀倾向;
9.正在接受或曾接受下列治疗:
a)随机前2周内,接受过外用药物治疗,如TCS、TCI、PDE抑制剂、Janus激酶(JAK)抑制剂等;
b)随机前4周内,接受过全身性中药(TCM)治疗,或者随机前2周内,接受过外用中草药治疗;
c)随机前2周内,接受过≥2次漂白浴;
d)随机前4周或5个半衰期内(以较长者为准)接受过系统性糖皮质激素或其他免疫抑制剂/免疫调剂剂;
e)随机前4周内接受过光疗、日晒床或任何其他发光装置治疗;
f)随机前6个月内接受过任何细胞耗竭剂,包括但不限于利妥昔单抗;随机前3个月内或5个半衰期内(以较长者为准)接受过任何单克隆抗体治疗(如度普利尤单抗等);
g)经研究者判断,既往使用抗IL-4和/或IL-13药物(如度普利尤单抗等)治疗,无应答或疗效不佳;
h)筛选前6个月接受过变应原特异性免疫疗法(SIT)治疗;
i)筛选期开始使用处方润肤剂或含有神经酰胺、透明质酸、尿素或丝聚蛋白降解产物等添加剂的润肤剂治疗AD;
10.筛选或基线时有任何一项检查指标符合下列标准:
a)总胆红素(TBIL)>1.5倍正常值上限(ULN);
b)丙氨酸氨基转移酶(ALT)或天门冬氨酸氨基转移酶(AST)>2倍ULN;
c)血清肌酐(Cr)>1.5倍ULN;
d)血白细胞计数低于正常值下限,经研究者判断有临床意义且不适合纳入研究;
11.筛选时乙肝表面抗原(HBsAg)阳性或丙肝病毒抗体(HCVAb)阳性[须进一步通过乙肝病毒脱氧核糖核酸(HBVDNA)滴度检测或丙肝病毒核糖核酸(HCVRNA)检测(超过测定法的正常值范围需要排除)]、人类免疫缺陷病毒抗体(HIVAb)阳性、血清梅毒螺旋体抗体(TPAb)阳性;
12.随机前6个月内有酒精或药物滥用史;
13.已知对试验用药品的任何成分过敏或不耐受;
14.随机前2个月内或计划在研究期间接种活疫苗或减毒活疫苗;
15.随机前8周内参加过其他临床试验且使用过任何试验药物;
16.计划或预期将要在研究期间进行重大外科手术;
17.妊娠或计划在研究期间妊娠,或母乳喂养的女性;
18.根据研究者的判断,受试者由于其他疾病或原因不适合参加该研究。
研究者信息
主要研究者
姓名:张建中
学位:医学博士
职称:主任医师
单位名称:北京大学人民医院
各参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 北京大学人民医院 | 张建中 | 北京市西城区西直门南大街11号 |
| 2 | 浙江大学医学院附属第四医院 | 刘伦飞 | 浙江省金华市义乌市商城大道N1号 |
| 3 | 江西省皮肤病专科医院 | 胡国红 | 江西省南昌市青云谱区迎宾大道310号 |
| 4 | 南方医科大学皮肤病医院 | 杨斌 | 广东省广州市越秀区麓景路2号 |
| 5 | 杭州市第一人民医院 | 吴黎明 | 浙江省杭州市上城区浣纱路261号 |
| 6 | 嘉兴市第一医院 | 殷文浩 | 浙江省嘉兴市南湖区中环南路1882号 |
| 7 | 首都医科大学附属北京同仁医院 | 魏爱华 | 北京市东城区东交民巷1号 |
| 8 | 承德医学院附属医院 | 段昕所 | 河北省承德市双桥区南营子大街36号 |
| 9 | 天津市中医药研究院附属医院 | 张理涛 | 天津市红桥区北马路354号 |
| 10 | 常德市第一人民医院 | 朱建建 | 湖南省常德市武陵区人民路818号 |
| 11 | 河北医科大学第一医院 | 张国强 | 河北省石家庄市裕华区东岗路89号 |
| 12 | 山东省皮肤病医院 | 张福仁 | 山东省济南市槐荫区经十路27397号 |
| 13 | 福建医科大学附属第一医院 | 纪超 | 福建省福州市台江区茶中路20号 |
| 14 | 重庆医科大学附属第一医院 | 蔡涛 | 重庆市渝中区袁家岗友谊路1号 |
| 15 | 河南省人民医院 | 李建国 | 河南省郑州市金水区纬五路7号 |
| 16 | 中南大学湘雅二医院 | 肖嵘 | 湖南省长沙市芙蓉区人民中路139号 |
| 17 | 山东第一医科大学附属省立医院 | 党宁宁 | 山东省济南市槐荫区经五纬七路324号 |
| 18 | 上海市皮肤病医院 | 丁杨峰 | 上海市静安区保德路1278号 |
| 19 | 内蒙古医科大学附属医院 | 吕新翔 | 内蒙古自治区呼和浩特市回民区通道北街1号 |