阿斯利康AZD5305临床试验,评估AZD5305剂量递增单药治疗和与抗癌药物联合治疗晚期实体恶性肿瘤安全性、耐受性、药代动力学、药效学和初步有效性的I/IIa期临床试验
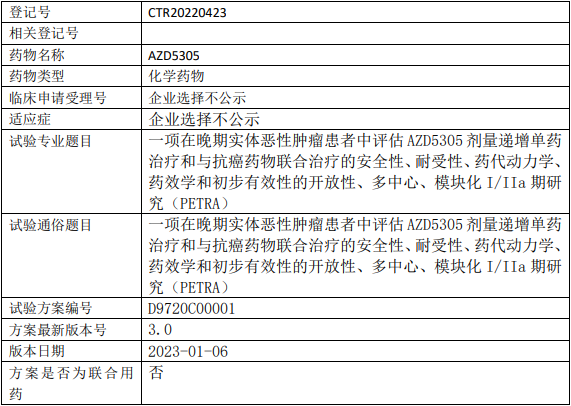
试验目的
1、评估AZD5305单药治疗和与抗癌药物联合治疗用于晚期恶性肿瘤患者的安全性和耐受性;
2、确定AZD5305作为单药治疗以及与抗癌药物联合治疗时,在单次口服给药后和多次口服给药后达到稳态时的血浆PK;
3、评估AZD5305作为单药治疗以及与抗癌药物联合治疗的初步抗肿瘤作用。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、实施任何研究特定步骤、采样和分析前,提供已签字并签署日期的书面知情同意书。
2、患者必须罹患经组织学或细胞学证实的晚期恶性肿瘤且适合研究治疗。
3、东部肿瘤协作组体能状态(ECOG PS评分:0~2),过去2周内无恶化。
4、入组研究时癌症进展。
5、患者必须有可评价的疾病。
6、器官和骨髓功能良好。
排除标准
1、与已知可延长或缩短QT间期并具有尖端扭转性室性心动过速风险的药物合并用药。
2、在首次给药前4周内,因任何原因以>10mg泼尼松/天或等效剂量连续接受皮质类固醇。
3、除脱发外,在开始研究治疗时,既往治疗导致的任何大于不良事件通用术语标准(CTCAE)1级的未缓解毒性。
4、在研究治疗首次给药前4周内进行过大手术。
5、脊髓压迫或脑转移,除非在研究治疗开始前至少4周内无症状、经过治疗、稳定,且不需要以 > 10 mg泼尼松/天或等效剂量连续接受皮质类固醇治疗。
6、已知有任何出血倾向的患者(例如,活动性消化性溃疡、近期[6个月内]发生过出血性卒中、增生性糖尿病视网膜病变)。
7、研究治疗首次给药前4周内接受过宽野放疗或2周内接受过固定野姑息放疗。