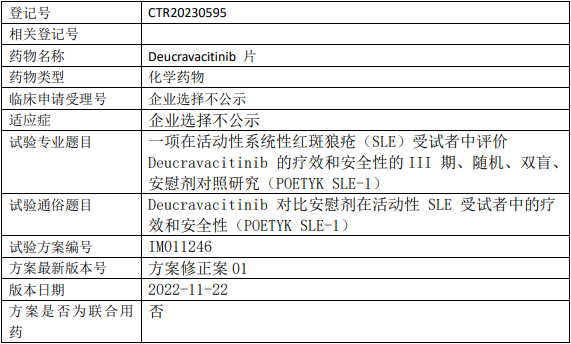
百时美施贵宝氘可来昔替尼临床试验,评价氘可来昔替尼片(Deucravacitinib、Sotyktu、BMS-986165、德卡伐替尼)治疗活动性系统性红斑狼疮(SLE)疗效和安全性的III期临床试验
试验目的
主要目的
证明与安慰剂相比,接受Deucravacitinib治疗的系统性红斑狼疮受试者在系统性红斑狼疮应答者指数-4应答上具有优效性。
次要目的
1、评价与安慰剂相比,Deucravacitinib在其他临床疾病活动度指标方面的疗效;
2、评估活动性系统性红斑狼疮受试者的疲乏状态。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署书面知情同意书
2、在筛选访视前的至少24周诊断为SLE。
3、符合欧洲风湿病学会联盟(EULAR)/美国风湿病学会(ACR)2019年SLE分类标准。
4、符合以下情况之一:由中心实验室在筛选期确定的筛选时抗核抗体(ANA)≥1:80为阳性或筛选时抗dsDNA抗体为阳性或筛选时抗Smith抗体(抗Sm抗体)为阳性。
5、SLEDAI-2K总评分≥6分且临床SLEDAI-2K评分≥4分伴关节受累、和/或皮肤血管炎、和/或皮疹(且必须由RRG确认)。i)如有指征,必须在SLEDAI-2K上记录狼疮头痛、脱发、器质性脑综合征和粘膜溃疡,但不计入筛选时入组要求的得分。注:临床SLEDAI-2K排除血尿、脓尿、尿管型、蛋白尿、抗dsDNA阳性、补体降低、血小板减少症和白细胞减少症等实验室异常。
6、筛选时必须至少存在1个BILAGA级或2个BILAGB级,须包括至少1种下述基于BILAG的方案特定的粘膜皮肤或肌肉骨骼SLE表现(必须由RRG确认):
i)皮肤粘膜身体系统存在BILAGA或B级。如果皮肤粘膜疾病的BILAGB级是由BILAG#6轻度皮疹引起,则皮肤红斑狼疮疾病面积和严重程度指数(CLASI)疾病活动度红斑和鳞屑部分的总评分必须≥3(不包括粘膜溃疡和非瘢痕性脱发)。
ii)由活动性多发性关节炎引起的改良BILAG肌肉骨骼系统的A或B评分定义如下:
(1)BILAGA:重度关节炎(BILAG#41),表现为在≥6个关节中观察到活动性滑膜炎。
(2)BILAGB:中度关节炎或肌腱炎或腱鞘炎(BILAG#42),定义为≥3个关节的肌腱炎/腱鞘炎或活动性滑膜炎(观察到或通过既往史评估)。
(3)如果皮肤粘膜身体系统或肌肉骨骼身体系统中不存在A级,并且皮肤粘膜或肌肉骨骼身体系统中仅存在1个B级(根据上述规定),则其他身体系统中必须至少存在1个B级(保障至少2个身体系统BILAGB级)。
7、筛选访视前需要接受至少一种以下SLE背景治疗(免疫抑制剂和/或抗疟药)≥12周,筛选访视前剂量必须保持稳定≥8周,并且直至随机分组以及在整个研究参与期间均必须保持剂量稳定使用。
8、允许但不要求使用OCS(泼尼松或等效剂量)背景治疗。对于使用OCS的受试者,剂量必须在筛选访视前稳定≥2周,在筛选时不得超过30mg/天,并且必须保持剂量稳定直至第4周访视。受试者可以同时接受一种OCS以及一种抗疟药和/或一种免疫抑制剂。
9、允许使用口服和/或外用非甾体抗炎药(NSAID)(包括阿司匹林或环氧合酶-2抑制剂)作为稳定剂量治疗或按需治疗,前提是在各自说明书规定剂量和频率范围内使用。接受NSAID治疗的受试者必须同意遵守研究访视相关的限制。
10、允许使用阿片类镇痛药,前提是给药剂量不超过每天30mg吗啡或等效剂量(常用阿片类药物的吗啡毫克等效剂量参见附录25)。接受阿片类药物的受试者必须同意遵守研究访视相关的限制(见第7.7.3节:限制使用的合并SLE用药和其他限制治疗)。
11、所有受试者都必须接受RRG的入组合格性审查,并需在随机化之前获得其对入组合格性的确认。
12、仅适用于可选长期扩展期的入选标准:
1)签署书面知情同意书;
2)完成方案要求的双盲治疗期并正在接受设盲研究药物。注:如果受试者由于特殊情况未接受设盲研究药物(例如由于COVID-19大流行而遗漏临床试验用[药品][IP/IMP]),则经医学监查员批准后,可允许受试者入组。
排除标准
1、诊断为药物诱导的SLE而非特发性SLE。对于之前诊断为药物诱导的SLE,而后续又确定为与药物无关的情况,必须与RRG讨论。
2、排除患其他自身免疫性疾病(例如,多发性硬化、银屑病、炎性肠病等)患者。不排除患有I型自身免疫性糖尿病、甲状腺自身免疫性疾病、乳糜泻或继发性干燥综合征的受试者。
3、排除SLE重叠综合征(包括但不限于类风湿性关节炎、硬皮病和混合性结缔组织病)的受试者。
4、合并纤维肌痛、慢性疲乏综合征或慢性疼痛综合征的受试者,如果经与入组资格审评者的讨论,认为其症状或治疗很可能显著影响SLE疾病表现和活动性的评估或解读时,需要排除。
5、伴有以下任何一项的抗磷脂综合征(APS):
i)根据Sapporo标准定义确诊的APS:
(1)如果在筛选前12个月内发生过血栓事件或病理妊娠;
(2)如果在筛选前超过12个月发生血栓事件或病理妊娠,且受试者未继续接受适当的治疗。
ii)灾难性抗磷脂综合征(CAPS)病史。
iii)筛选时抗磷脂抗体结果为阳性,有血栓形成或死胎/胚胎丢失,未诊断为APS,但根据EEAC评估认为存在血栓形成风险增加。
6、活动性或不稳定性狼疮神经精神表现,包括但不限于符合BILAGA标准定义的任何疾病。
7、排除需要或可能需要细胞毒性药物或高剂量CS治疗的活动性、重度III级和IV级狼疮性肾炎患者。既往有肾病但已控制,血清肌酐≤2×正常值上限(ULN),且残余蛋白尿不超过3g/天或尿蛋白/肌酐比(UPCR)达到3mg/mg或339mg/mmol的受试者可允许入组。肾病的稳定性须有过去6个月的至少2次蛋白尿或UPCR测量值记录证明。
8、妊娠期、哺乳期或计划在研究期间怀孕的女性。
9、有任何重大疾病/病症或不稳定临床病症(例如肾、肝、血液学、胃肠道、内分泌、肺、免疫、精神)或活动性感染/感染性疾病的证据,且根据医学判断将显著增加参加研究的风险。
10、有癌症或过去5年内有癌症或淋巴组织增生性疾病史(经充分治疗且无复发证据的皮肤基底细胞癌或鳞状细胞癌除外)。
11、在筛选前24周内因心力衰竭而住院,或被认为正患有纽约心脏病协会III/IV级心力衰竭(超过轻度症状[轻度呼吸短促]和/或受到超过轻度的日常活动限制)。
12、筛选前24周内发生过急性冠脉综合征(例如心肌梗死、不稳定型心绞痛)和/或任何重大脑血管疾病。
13、根据医学判断,存在非SLE合并疾病,研究期间很可能需要额外进行大量全身性糖皮质激素治疗(例如,哮喘)。
14、筛选时有活动性横纹肌溶解或肌酸激酶>5xULN,除非EEAC确认升高是由SLE肌炎引起的。
15、在洗脱期内暴露于禁用的免疫调节药物(如环孢素)或生物药物(如利妥昔单抗、贝利尤单抗、托珠单抗等)。如果某种药物未具体列出,请咨询医学监查员获取指导。
16、不能遵守第7.7.3节:限制使用的合并SLE用药和其他限制治疗以及第7.7.2节:禁用的治疗中规定的限制和/或禁用治疗标准。
17、筛选时使用1种以上免疫抑制剂。
18、OCS(泼尼松或等效剂量)≥30mg/天。
19、既往暴露于TYK2抑制剂
20、既往暴露于干扰素αkinoid。
21、既往对anifrolumab无应答。(所有既往暴露于anifrolumab的受试者均将由外部EEAC进行审评,并根据需要对有关应答程度的详细信息提出质询。)
22、在筛选前12周或5个半衰期内(以较长者为准)暴露于试验性药物。
23、在筛选前4周内使用过植物制剂(例如,草药补充剂或植物、矿物质及动物源性的中药)。
24、符合以下任何一项结核病(TB)标准:
i)筛选访视前有活动性TB病史(无论是否完成了充分的治疗)。
ii)根据研究者判断,筛选期间存在活动性TB的体征或症状(例如发热、咳嗽、盗汗和体重下降)。
iii)在筛选期或筛选前6个月内的任何时间获得的任何胸部影像学检查(例如,胸部x光检查、胸部计算机断层扫描),证实当前患有活动性肺结核或有活动性肺结核病史。
iv)潜伏性TB感染(LTBI)定义为筛选时QuantiFERON®-TBGold检测干扰素-γ释放试验(IGRA)阳性(无临床表现)或根据病史已知为QuantiFERON®-TBGold检测阳性,但不符合关于IGRA阳性的备注中概述的合格性条件。
25、筛选时存在丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)或人类免疫缺陷病毒(HIV)的证据或阳性检测结果。
26、近期发生带状疱疹或单纯疱疹感染或有严重带状疱疹或单纯疱疹感染病史,定义为:随机分组前30天内有带状疱疹或单纯疱疹病灶,或严重带状疱疹或严重单纯疱疹感染病史,包括但不限于任何播散性单纯疱疹发作、多皮区带状疱疹、疱疹性脑炎、眼科疱疹和/或复发性带状疱疹(复发性带状疱疹定义为过去2年内发作超过2次)。
27、当前正在接受任何慢性感染治疗(例如肺囊虫、带状疱疹、巨细胞病毒、侵袭性细菌或真菌感染,或非典型分枝杆菌)。
28、有先天性或获得性免疫缺陷病史。
29、随机前14天内有与SLE无关的活动性感染和/或发热性疾病病史或证据
30、已知随机分组前30天内存在活动性感染,或需要住院或肠外(肌肉内或IV)抗菌药物(例如抗生素、抗病毒药、抗真菌药或抗寄生虫药)治疗的任何重大感染发作,或随机分组前2周内接受口服抗菌药物治疗。注:对于严格接受抗菌药物预防性治疗的受试者,应与医学监查员/指定人员讨论其入选资格。
31、随机分组前60天内或治疗期间任何时间或Deucravacitinib末次给药后60天内接种活疫苗。
32、胸部x光或ECG出现具有临床意义的异常。
33、实验室检查结果出现具有临床意义的异常
34、仅适用于可选长期扩展期的排除标准:
1)研究者认为将会使得受试者不适合参加本研究、会干扰受试者的安全性或研究结果解读或因任何其他原因被研究者认为导致受试者不适合参加本研究的任何疾病或医学状况。
2)经研究者判断存在活动性TB证据,或存在LTBI证据(表现为IGRA阳性或IGRA不确定且当地专家没有表示无需治疗的情况)但受试者不愿意接受预防性治疗。