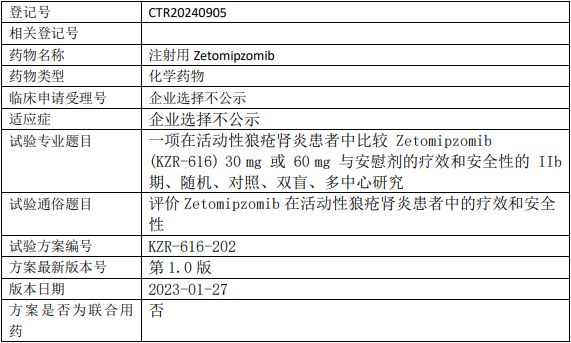
云顶新耀Zetomipzomib临床试验,比较Zetomipzomib(泽托佐米、KZR-616)30mg或60mg与安慰剂治疗活动性狼疮肾炎疗效和安全性的IIb期临床试验
试验目的
评估Zetomipzomib在活动性III或IV型(伴或不伴V型;III/IV+/-V型)狼疮肾炎(LN)和单纯V型LN患者中的疗效和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、在签署知情同意书时年满18岁。
2、体重指数≥18kg/m2。
3、筛选访视时ANA检测结果明确呈阳性,定义为ANA滴度≥1:80(基于Hep-2免疫荧光测定或酶免疫测定得出的等效结果)和/或血清抗体检测抗dsDNA结果呈阳性(基于酶联免疫吸附试验≥30IU/mL)。
4、根据2003年或2018年ISN/RPS标准诊断为LN,疾病分型为以下情况之一:
a.筛选前12个月内或筛选期间进行的肾脏活检证实为III或IV型LN。除III或IV型疾病外,患者还可能同时出现V型疾病。如果活检在筛选访视前>6个月进行,筛选时还必须存在以下至少一项:C3偏低、C4偏低或抗dsDNA高于正常范围;
b.筛选前12个月内或筛选期间进行的肾脏活检证实为单纯V型LN。此外,筛选前必须使用稳定剂量的肾素-血管紧张素-醛固酮系统抑制剂(RAASi)降压药至少1个月,且筛选时收缩压必须≤130mmHg。
5、确认蛋白尿,定义为a.对于III/IV+/-V型LN患者,筛选期内间隔至少7天的两次24小时尿液样本评估UPCR≥1.0。b.对于单纯V型LN患者,筛选期内间隔至少7天的两次24小时尿液样本评估UPCR≥2.0。
6、根据慢性肾脏疾病流行病学合作研究公式(2021)计算的eGFR≥30mL/min/1.73m2。
7、具有充分的血液学、肝脏和肾脏功能。
排除标准
1、在筛选前52周内接受过透析。
2、有SLE引起的活动性中枢神经系统表现。
3、患有任何重叠的自身免疫性不良状况,该不良状况或其治疗可能会影响研究评估或结局(例如,系统性硬化或任何需要额外免疫抑制的不良状况)。不排除预期病情或治疗不会影响评估或结局的重叠不良状况(例如,干燥综合征)。
4、在筛选前52周内有抗磷脂综合征史伴血栓栓塞事件史。
5、有不稳定型血小板减少症病史,或发生具有临床意义的出血或器官功能障碍而需要血浆分离或急性输血或血小板输注等治疗的风险较高。
6、已知对≤1g/天的MMF或等效药物和皮质类固醇不耐受,或无法使用皮质类固醇。
7、筛选时人类免疫缺陷病毒(HIV)、乙型肝炎(表面抗原、核心抗体)或丙型肝炎(经丙型肝炎RNA确认的抗丙型肝炎病毒[HCV]抗体)检测结果呈阳性。
8、有任何类型的恶性肿瘤病史,但以下情况除外:
a.手术切除的非黑色素瘤皮肤癌;
b.完全切除>5年的原位宫颈癌;
c.认为已治愈且前列腺切除术后前列腺特异抗原正常>5年的前列腺癌;
d.认为在手术治疗后治愈>5年的结肠癌;
e.完全缓解>5年的淋巴瘤。
9、有实体器官移植史或计划在研究期间进行移植。