凌科药业LNK01001临床试验,评价LNK01001胶囊治疗特应性皮炎的Ⅰb期临床试验
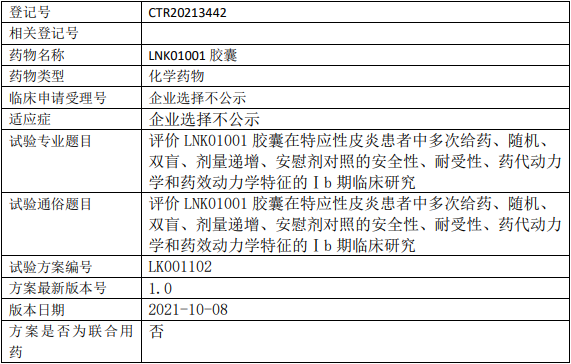
试验目的
主要目的
评价LNK01001胶囊在特应性皮炎患者中的安全性和耐受性;
评价LNK01001胶囊在特应性皮炎患者中的药代动力学(PK)特征。
次要目的
评价LNK01001胶囊在特应性皮炎患者中的药效动力学(PD)特征、药代动力学/药效动力学(PK/PD)相关性。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、试验前签署知情同意书、并对试验内容、过程及可能出现的不良反应充分了解;
2、能够按照试验方案要求完成研究;
3、受试者(包括伴侣)愿意自筛选至最后一次研究药物给药后6个月内自愿采取有效避孕措施
4、年龄为18~65岁男性和女性受试者
5、男性受试者体重不低于50公斤、女性受试者体重不低于45公斤。体重指数(BMI)=体重(kg)/身高2(m2),体重指数在18~32kg/m2范围内(包括临界值)
6、符合Hanifin&Rajka特应性皮炎(AD)诊断标准,筛选前AD病史≥6月
7、根据病史、实验室检查、体格检查、胸正位片检查和在筛选过程中进行的12导联心电图(ECG)的结果,判断受试者总体健康状况良好(AD除外)
排除标准
1、对LNK01001主要成分或辅料过敏者,或过敏体质(多种药物及食物过敏)
2、有吞咽困难或任何影响药物吸收的胃肠道疾病史者
3、患有恶性肿瘤或筛选前5年内任何恶性肿瘤史(但除外已完全切除的宫颈原位癌或非转移性皮肤鳞状细胞癌或基底细胞癌)
4、T-spot检查结果阳性者
5、筛选期心电图检查QTC,男性>470ms,女性>480ms,或经研究者判断为异常有临床意义
6、筛选前3个月内存在严重感染或筛选前7天内存在感染症状,经研究者判断不适合参加者
7、筛选前3个月内有单纯疱疹、带状疱疹病史者或水痘病史者
8、患有遗传学免疫缺陷或有遗传性免疫缺陷家族病史
9、试验开始前1个月内接种过活疫苗或减毒疫苗者
10、有酗酒史(每周饮用14个单位的酒精:1单位=啤酒285mL,或烈酒25mL,或葡萄酒100mL)
11、在筛选前三个月内献血或大量失血(>450mL)者,或打算在研究期间或研究结束后1个月内献血者
12、筛选前3个月内参加过任何药物或医疗器械临床试验者
13、患有任何增加出血性风险的疾病,如胃及十二指肠溃疡等
14、女性受试者在筛查期或试验过程中正处在哺乳期或血清妊娠结果阳性
15、病毒性肝炎(包括乙肝和丙肝)、艾滋病抗原/抗体、梅毒螺旋体抗体筛选阳性者,或乙肝表面抗原阴性、乙肝表面抗体阴性、乙肝核心抗体阳性且HBVDNA定量>0者
16、从筛选阶段至研究用药前发生急性疾病
17、在服用研究药物前24小时内服用过特殊饮食(包括火龙果、芒果、柚子等)或有剧烈运动,或其他影响药物吸收、分布、代谢、排泄等因素者
18、在服用研究药物前24小时内摄取了巧克力、任何含咖啡因或富含黄嘌呤的食物或饮料
19、在服用研究药物前24小时内服用过任何含酒精的制品或酒精呼气检测阳性者
20、尿药筛查阳性者或在过去五年内有药物滥用史或使用过毒品者
21、患有任何可能影响试验结果评价的全身性疾病或活动性的其它皮肤疾病(如银屑病、脂溢性皮炎、红斑狼疮),或在患处有瘢痕、胎斑、纹身、明显色素沉着等会影响皮肤病变的评价者
22、皮肤病变仅局限在手、足者
23、有明显的皮肤局部细菌、病毒及真菌感染者
24、给药前4周内的AD全身性治疗,包括但不限于糖皮质激素、甲氨蝶呤、环孢霉素、硫唑嘌呤、磷酸二酯酶4(PDE4)抑制剂、干扰素-γ、霉酚酸酯;靶向生物治疗[指5个半衰期内(如果已知)或12周内,以较长时间为准];在4周内的可影响疾病严重程度或干扰疾病评估的光照疗法、激光治疗、人工日光浴,或长时间的太阳暴晒;在2周内的局部治疗,包括但不限于外用糖皮质激素(TCS)、钙调神经磷酸酶抑制剂(TCI),或局部磷酸二酯酶4(PDE4)抑制剂
25、6个月内内使用过JAK抑制剂(包括但不限于ruxolitinib/芦可替尼、tofacitinib/托法替尼、baricitinib/巴瑞克替尼、filgotinib、lestaurtinib/来他替尼、pacritinib/帕克替尼、Delgocitinib、Upadacitinib/乌帕替尼、ATI-501/502、PF-04965842)
26、本研究首次给药前14天内使用过CYP3A4、CYP2C19、CYP2C9或CYP2C8强效抑制剂或诱导剂(如苯妥英钠、伏立康唑、氟康唑、胺碘酮等)或者使用过经以上代谢途径的药物未超过该药物的5个半衰期者(以时间长者为准)
27、在开始给药前6个月内使用细胞耗竭剂(如利妥昔单抗、奥妥珠单抗等)
28、有明显心、血管、肺、胃肠道、肝、胰、肾、血液、神经和心理疾病的,且病情不稳定或未能得到很好控制者;有慢性头痛病史且近3个月有反复发作的情况;有慢性胃炎病史且有进食障碍或吸收障碍经研究者评估会影响研究评估、或影响依从性
29、患有精神疾病,或抑郁症病史,和/或在筛选期及基线时根据哥伦比亚-自杀严重程度量表(C-SSRS)评估有自杀想法或任何自杀行为(PosnerKetal,2011)。若受试者对C-SSRS问卷上任何一个问题回答了“是”,或研究者临床上判断有自杀风险
30、肝功能损害,ALT或AST≥正常值上限的1.5倍;肾功能损害,肾功能Cr﹥正常值上限的1.5倍
31、白细胞计数<3.0×109/L;中性粒细胞计数<1.5×109/L;血红蛋白<90g/L;血小板<100×109/L
32、其他引起嗜酸粒细胞增多的疾病
33、研究者认为具有其他不适宜参加本试验因素的受试者