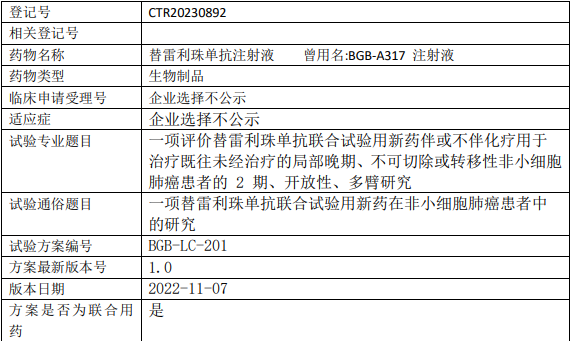
百济神州替雷利珠单抗临床试验招募,评价替雷利珠单抗注射液(BGB-A317)联合试验用新药伴或不伴化疗用于治疗既往未经治疗的局部晚期、不可切除或转移性非小细胞肺癌患的II期临床试验
试验目的
主要目的
评价替雷利珠单抗联合试验用新药伴或不伴化疗在基于PD-L1表达状态选定的非小细胞肺癌(NSCLC)患者中的有效性和安全性。
注:根据PD-L1表达水平(分别为PD-L1高表达[≥50%]和PD-L1低表达或阴性[<50%包括1%~49%和<1%]),将患者分配至2个子研究(子研究1或子研究2)。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、能提供书面知情同意,并理解且同意遵循研究要求和评估计划。
2、在签署知情同意书时年龄≥18岁(或研究开展地区管辖范围内的法定同意年龄)。
3、经组织学或细胞学证实的局部晚期或复发性NSCLC(非鳞状或鳞状)且不适合根治性手术和/或根治性放化疗,或转移性NSCLC。注:混合性非小细胞组织学类型肿瘤将按主要细胞类型进行分类
4、既往未接受过主要针对转移性NSCLC的全身治疗。注:对于既往接受过针对局部晚期疾病的辅助/新辅助化疗或根治性放化疗/辅助放疗的患者,如果化疗和/或放疗的末次给药发生在随机化/入组前至少6个月,则允许入组。
5、同意提供存档组织(含肿瘤的经福尔马林固定石蜡包埋组织[首选]或约15张新鲜切割的未染色组织切片)或新鲜组织活检(如果无法获得存档组织),供中心实验室进行PD-L1水平的前瞻性检测(如果当地无法获得PD-L1表达状态)及用于生物标志物回顾性分析。
6、由当地实验室(使用22C3[Dako]、SP263[Ventana]或28-8[Dako])或中心实验室(使用SP263[Ventana])检测存档肿瘤组织或新鲜活检组织确定肿瘤PD-L1表达可评价。PD-L1表达未知的患者将不符合本研究入组条件。
7、根据RECIST1.1版定义至少有1个可测量病灶。注:病灶位于既往接受过局部治疗(包括既往放疗)的区域不视为可测量病灶,除非根据RECIST1.1版定义评估该区域病灶在局部治疗后发生了疾病进展。
8、美国东部肿瘤协作组(ECOG)体能状态评分为0或1
排除标准
1、患有混合型小细胞肺癌
2、已知有可靶向治疗的基因突变(包括但不限于EGFR、ALK、BRAF、RET和ROS1突变)且相应靶向治疗已经被卫生当局批准的患者。
3、既往接受过抗PD-1、抗PD-L1、抗程序性细胞死亡配体-2(PD-L2)、抗T胞免疫球蛋白和ITIM结构域(TIGIT)、抗淋巴细胞活化基因-3(LAG-3)或任何其他特异性靶向T细胞共刺激或免疫检查点通路的抗体或药物治疗。注:既往在新辅助、辅助、巩固治疗阶段接受肿瘤免疫治疗(靶向PD-1或PD-L1)的患者,只要在肿瘤免疫治疗末次给药至疾病影像学复发前的无治疗间隔≥6个月,则允许入组。
4、在随机化/入组前≤14天受过任何用于控制癌症的中草药或中成药
5、有活动性软脑膜疾病或未得到控制、未经治疗的脑转移:有中枢神经系统(CNS)转移治疗史且筛选时稳定的患者,只有符合以下所有条件才可以入组:
●筛选时的脑成像无中期进展证据,且无新发脑转移证据。
●患者临床稳定≥2周-脑转移不是唯一病灶-当前不需要使用皮质类固醇治疗CNS疾病;随机化/入组前3天已停用皮质类固醇;允许使用剂量稳定的抗惊厥药。
●随机化/入组前≤14天没有进行立体定向放射或全脑放疗-无软脑膜疾病证据。