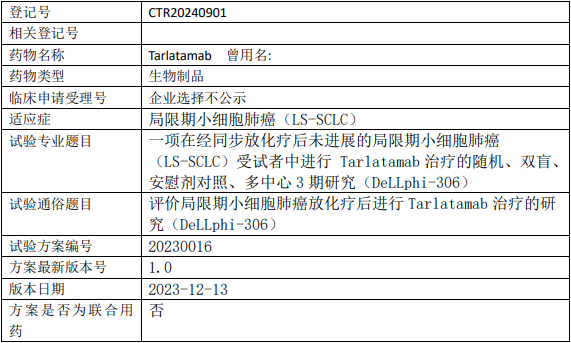
百济神州塔拉妥单抗临床试验,塔拉妥单抗(Tarlatamab、AMG757)治疗经同步放化疗后未进展的局限期小细胞肺癌随机、双盲、安慰剂对照、多中心的III期临床试验
试验目的
本研究是一项随机、双盲、安慰剂对照、多中心、3期研究,目的是在完成同步放化疗后未进展的LS-SCLC受试者中评价塔拉妥单抗(Tarlatamab、AMG757)治疗的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至 无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、只有满足以下所有标准的受试者才有资格入组研究: 受试者已在开始任何研究特定活动/程序之前提供知情同意书。
2、年龄≥ 18岁(若该国家/地区的法定成年年龄大于18岁,则需≥该法定成年年龄)。
3、经组织学或细胞学确诊为SCLC。
4、确诊为LS-SCLC并接受同步放化疗。
5、已完成放化疗,且根据RECIST 1.1评估为无疾病进展。
6、美国东部肿瘤协作组(ECOG)体能状态(PS)评分为0或1。
7、预期寿命至少为12周。
8、器官功能良好。
9、归因于同步放化疗的毒性恢复至≤ 1级,除非另有说明。不包括脱发。
排除标准
1、如果受试者符合以下任一标准,则将其从研究中排除: 疾病相关:
●广泛期SCLC(ES-SCLC);
●既往确诊为转化性非小细胞肺癌(NSCLC)、已转化为SCLC的表皮生长因子受体(EGFR)激活突变阳性的NSCLC,或经组织学确诊为SCLC与NSCLC成分混合的情况;
●有证据表明存在间质性肺病或活动性非感染性肺炎。
2、其他医学状况:
●过去2年内有其他恶性肿瘤病史,特定情况除外;
●实体器官移植史;
●研究治疗首次给药前6个月内发生心肌梗死和/或症状性充血性心力衰竭(纽约心脏病学会标准II级以上);
●研究治疗首次给药前6个月内有动脉血栓形成史(例如,卒中或短暂性脑缺血发作);
●根据方案排除已知存在人类免疫缺陷病毒(HIV)感染、肝炎的受试者;
●受试者在研究治疗首次给药前7天内有症状和/或临床体征和/或影像学体征,提示急性和/或未受控制的活动性全身感染。
3、既往/合并治疗:
●放化疗期间接受序贯化疗和胸部放疗(胸部放疗与化疗无重叠);
●既往接受过任何DLL3通路选择性抑制剂治疗;
●任何免疫疗法导致的重度或危及生命的事件既往史;
●正在接受另一种抗肿瘤治疗,允许乳腺癌切除术后的辅助激素治疗;
●入组前7天内接受全身皮质类固醇治疗或任何其他形式的免疫抑制治疗;
●研究治疗首次给药前28天内接受过大手术;
●研究治疗首次给药前14天内接种过活病毒治疗,包括减毒活疫苗,研究治疗首次给药前3天内接种过非活疫苗。
4、既往/同期临床研究经验:入组前28天内接受过其他试验性研究的治疗。
5、其他排除标准:
●有生育能力的女性受试者,不愿意在治疗期间和研究治疗末次给药后72天内使用研究方案规定的避孕方法;
●在研究期间至研究治疗末次给药后72天内哺乳或计划在该时间段内哺乳的女性;
●计划在研究期间至研究治疗末次给药后72天内怀孕或捐献卵子的女性,筛选时通过高灵敏度血清妊娠试验评估为妊娠试验阳性的有生育能力的女性受试者;
●具有育龄女性伴侣,且不愿意在治疗期间和研究治疗末次给药后132天内禁欲(避免发生异性性交)或使用避孕措施的男性受试者;
●不愿意在治疗期间和研究治疗末次给药后132天内避免捐献精子的男性受试者;
●已知受试者对给药期间给予的任一产品或成分过敏;
●尽受试者和研究者所知,受试者有可能无法完成所有研究方案要求的研究访视或程序,和/或遵守所有要求的研究程序(例如临床结局评估);
●研究者或Amgen医学监查员(如果咨询)认为,任何其他具有临床意义的障碍、病 症,或疾病的历史或证据(上述列出的除外)将对受试者安全性造成风险或干扰研究评价、程序或完成。