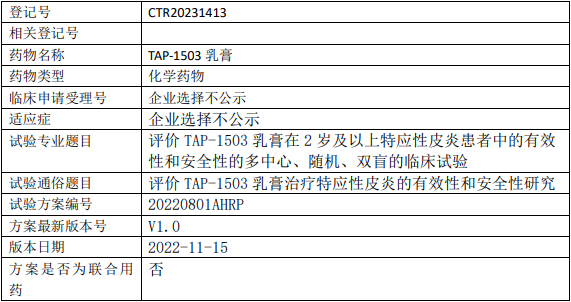
泽德曼医药TAP-1503临床试验,评价TAP-1503乳膏治疗2岁及以上特应性皮炎有效性和安全性的多中心、随机、双盲的III期临床试验
试验目的
评价TAP-1503乳膏在2岁及以上特应性皮炎患者中的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:2岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥2岁,经临床诊断为特应性皮炎患者(HanifinandRajkacriteria);
2、男女不限;
3、BSA为5~35%(不含头皮部位),并适用外用疗法;
4、基线期及筛选期,IGA≥3分;
5、经研究者评估病情稳定,无自发改善或迅速恶化;
6、有生育潜能(包括已有月经初潮且不满足无生育潜能标准的女性受试者)的育龄女性基线期筛选检查时血妊娠试验阴性,并同意在研究期间采取有效避孕措施。
无生育潜能的女性受试者需至少满足以下一项标准:
①处于绝经后状态,其定义为:在无其他病理学或生理学原因的前提下至少连续停经12个月;
②接受过子宫切除和/或双侧卵巢切除术,且有档案记录;
③医学证实卵巢衰竭;
7、充分了解试验内容,自愿参加试验,已签署知情同意书。
排除标准
1、有严重的中枢神经系统、心血管系统、肾脏、肝脏、消化道、呼吸系统、代谢及骨骼肌肉系统疾病者;
2、急性或慢性精神病患者,包括过去一年内存在主动自杀意念或行为或相关实验室异常,或可能干扰研究用药或研究结果的解释等,且经研究者判断不适合参与本研究
3、肝功能血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)>正常上限值2倍,或肾功能血清肌酐高于正常值上限1.5倍者;
4、在近5年内具有癌症史或因任何类型的癌症接受过治疗(仅通过冷冻手术或手术切除治愈的鳞状细胞癌、基底细胞癌或皮肤原位癌除外);
5、人免疫缺陷病毒感染、丙型肝炎病毒感染活动期、乙肝病毒感染活动期、甲型肝炎病毒感染活动期或梅毒螺旋体抗体阳性者;
6、妊娠期、哺乳期女性、有妊娠计划的女性;
7、已知对研究药物的活性成分或辅料过敏者;
8、在试验开始前3个月内参加过任何其他药物临床试验的受试者;
9、经常使用中草药或镇静剂、安眠药、安定剂及其他成瘾性药物者;
10、患有其他可能干扰特应性皮炎临床评估和/或有除特应性皮炎外的其他严重皮肤病史者;
11、患有慢性或急性全身性或浅表感染,并需要在基线访视前1周内使用系统或局部抗菌剂或抗真菌药者;
12、基线访视前5个半衰期内接受过已知可影响特应性皮炎的系统型生物制剂治疗者(如度普利尤单抗)。