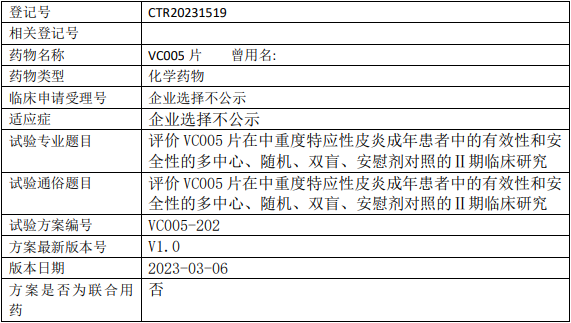
威凯尔医药VC005临床试验,评价VC005片治疗中重度特应性皮炎有效性和安全性的多中心、随机、双盲、安慰剂对照的Ⅱ期临床试验
试验目的
主要目的
·使用湿疹面积和严重程度指数(EASI)评分比较不同剂量的VC005在中重度AD成年受试者中的疗效。
次要目的
·使用其他疗效终点比较不同剂量的VC005在中重度AD成年受试者中的疗效;
·评价不同剂量的VC005治疗中重度AD成年受试者的安全性;
·评价VC005在中重度AD成年受试者中的药代动力学(PK)特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、患者理解并自愿签署ICF,有意愿和能力完成方案要求的定期访视、治疗计划、实验室检查及其他试验过程。
2、签署ICF时年龄≥18且≤75周岁的男性或女性患者。
3、筛选时符合Hanifin-Rajka诊断标准且基线前至少1年出现AD症状。
4、筛选和基线时,根据研究者评估,符合中重度AD标准。
5、经研究者判断,近期(在筛选前1年内)接受过AD外用治疗且临床应答不充分或不耐受。
6、能够并且愿意从基线前至少7天开始,仅使用稳定剂量的由申办者统一提供的不含影响疗效评价成分的润肤剂,并在研究期间持续使用。
7、非哺乳期的有生育能力的女性患者(WOCBP),在筛选时妊娠检查结果为阴性且承诺在研究期间以及试验用药品治疗结束后的28天内采取充分有效的避孕措施或禁欲。
8、男性患者承诺在研究期间以及试验用药品治疗结束后的28天内采取充分有效的避孕措施或禁欲。
排除标准
1、存在无法吞咽试验用药品或难治性恶心和呕吐、吸收不良、体外胆汁分流或者患有影响药物吸收的胃肠道疾病(比如克罗恩病,溃疡性结肠炎,或短肠综合征)或其他吸收不良情况或目前患有或有淋巴增生性疾病的病史等。
2、筛选检查时白细胞计数(WBC)<3×109/L。
3、基线前14天内使用全身性抗感染药物或基线前2周内,使用过任何AD局部治疗等。
4、筛选时γ-干扰素(IFN-γ)释放试验(QUANTIFERON®-TB GOLD或T-SPOT.TB®)测试结果为阳性的受试者。
5、基线前3个月内大量失血、接受输血或献血(≥400 mL)。
6、已知或怀疑对VC005主要成分及辅料或同类药过敏者。
7、计划妊娠、妊娠期或哺乳期女性。
8、基线前6个月内有酗酒史[每周饮酒>14单位(1单位酒精≈360 mL啤酒或45 mL酒精含量为40%的烈酒或150 mL葡萄酒)],且试验期间不能停止者。
9、经研究者判断存在其他原因而不适合参加本临床试验的患者。