CAR-T细胞疗法治疗肺癌的目标与挑战
导读
肺癌是居全球恶性肿瘤发病率第2位、死亡率第1位的恶性肿瘤。非小细胞肺癌(non-small cell lung cancer, NSCLC)是临床最常见的肺癌类型,占所有肺癌的85%。近些年,以CTLA-4和PD-1/PD-L1抑制剂为代表的免疫治疗,以及靶向治疗显著改变了NSCLC患者的治疗效果。
CAR-T细胞疗法是嵌合抗原受体T细胞的一种免疫疗法,也是近年来免疫治疗中备受关注的疗法之一。CAR-T细胞疗法在血液肿瘤领域取得了巨大成功,那么在肺癌领域的应用前景如何呢?
近日,纪念斯隆凯特琳癌症中心联合哥伦比亚大学的专家学者在Curr Issues Mol Biol杂志发表了题为“Advances in CAR T Cell Therapy for Non-Small Cell Lung Cancer.”的综述文章,文章回顾了CAR-T细胞疗法在实体瘤中的挑战,并展示了在非小细胞肺癌(NSCLC)中的巨大前景。

图源 | mdpi.com
Part.1、CAR-T细胞疗法在实体瘤中的应用
相较于血液肿瘤,实体瘤具有肿瘤异质性强、靶抗原选择有限、T细胞浸润率低、免疫抑制肿瘤微环境(TME)等特点。因此,CAR-T细胞疗法在实体瘤上的应用具有局限性。迄今为止,已经采用了多种创新策略来改善CAR-T细胞克服实体瘤TME的不利影响。联合化疗、放疗或其他免疫疗法,如将CAR-T细胞与TGF-β靶向药物联合使用,在维持其抗肿瘤活性方面取得了有希望的临床前结果。此外,将CAR-T细胞直接引入肿瘤部位为克服其对实体瘤疗效的障碍提供了另一种选择。
一项试验评估胶质母细胞瘤患者人表皮生长因子受体2(HER2)特异性 CAR-T细胞的全身给药,在17例患者的队列中,中位总生存期为初始T细胞输注后11个月,诊断后25个月。另外一项针对glypican-3(GPC3)CAR-T细胞疗法治疗肝细胞癌患者的临床前研究显示,6个月、1年和3年的生存率分别为50%、42%和10%。还有一项I期临床试验,以评估转移性胰腺癌患者中的表皮生长因子受体(EGFR)CAR-T细胞疗效显示在14例患者中,8例病情稳定,4例出现持续2至4个月的部分缓解,疾病稳定的患者肿瘤细胞上EGFR表达降低,肝脏转移病灶缩小。
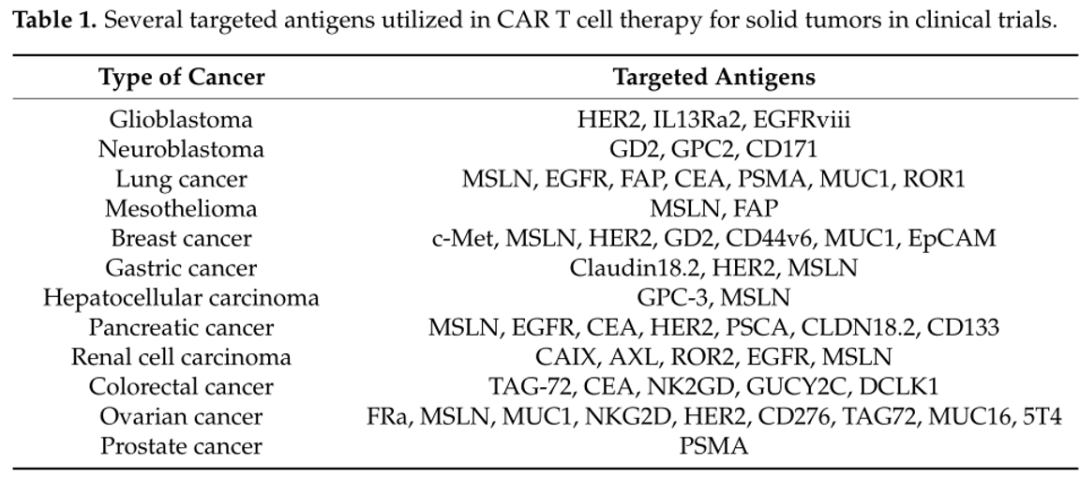
几种靶向抗原用于CAR - T细胞治疗实体瘤的临床试验
图源 | mdpi.com
Part.2、CAR-T细胞疗法在非小细胞肺癌中的应用
在NSCLC中CAR-T细胞疗法显示出巨大的前景。目前几种具有高特异性的靶抗原,可以克服与实体瘤特异性TME相关的障碍。包括表皮生长因子受体(EGFR)、间皮素(MSLN)、前列腺干细胞抗原(PSCA)和粘蛋白1(MUC1)。这些靶点和当前数据以及目前正在临床试验中的新靶点详述如下。
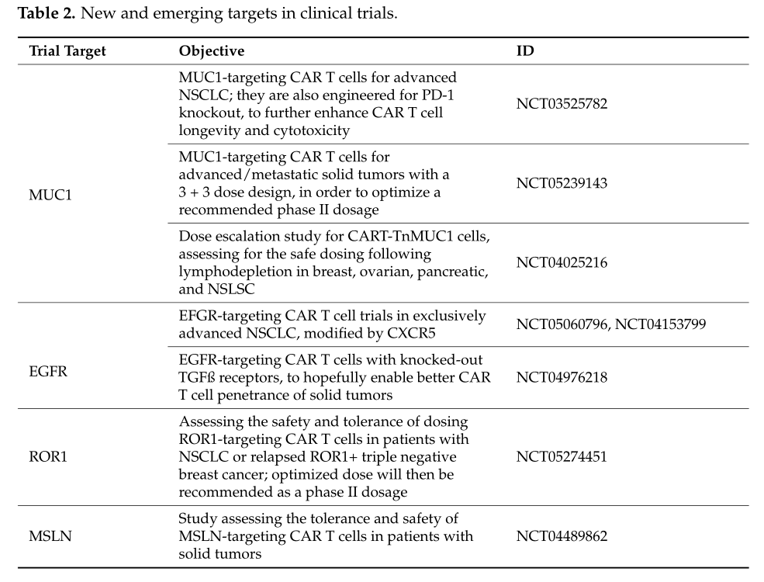
临床试验中新出现的靶点
图源 | mdpi.com
1、EGFR(表皮生长因子受体)
EGFR是一种酪氨酸激酶受体,可转导细胞外信号传导以促进细胞生长。约15%的NSCLC表达EGFR,使其成为CAR-T细胞疗法的主要靶点。2019年的一项临床前研究显示靶向EGFRvIII的第三代CAR-T细胞与对照MOCK-CAR细胞相比,它们在小鼠模型中的应用显著延长了生存时间并降低了肺部肿瘤负荷。另一项研究报道了类似的结果,当CAR-T细胞在肿瘤内递送时,细胞毒性增强。一项I期研究测试CXCR5修饰的CAR-T细胞对晚期NSCLC(NCT05060796)的抗EGFR作用,结果显示治疗耐受性良好。
2、MUC1(粘蛋白1,细胞表面相关)
癌性突变会导致MUC1表达,特别是在肺腺癌中。周等人在2019年的一项研究测试了CAR-T细胞对注射到小鼠体内的MUC1阳性肿瘤的影响,在注射后4天内显著降低了异种移植小鼠的肿瘤负荷。后续研究还观察到CAR-T细胞肿瘤毒性的寿命较长,因为这些细胞在治疗后长达81天,还杀死了新注射的肿瘤细胞。一项针对人类的初步研究试图将MUC1 CAR-T细胞与PD-1敲除T细胞相结合来治疗晚期NSCLC,显示出显著的原发性肿瘤减少。
3、MSLN(间皮素)
间皮素是一种免疫原性糖蛋白,与预后不良和化疗耐药有关,在非小细胞肺癌和间皮瘤细胞中大量表达,在健康组织中无明显表达。第二代靶向MSLN的CAR-T细胞的实验表明,尽管不能完全消除癌症,但具有抑制肿瘤生长的治疗潜力。迄今为止,临床试验尚未产生有希望的结果。
4、PSCA(前列腺干细胞抗原)
PSCA过表达最初在前列腺癌中被发现,但在胃癌、胆囊癌、胰腺癌和肺癌中也经常发生扩增。在患者来源的异种移植模型中,抗PSCA的第三代CAR-T细胞延缓了NSCLC的发生。另一项研究证明了PSCA定向CAR-T细胞对NSCLC的细胞毒性。添加MUC1靶向CAR-T细胞也显示出协同效应,总体肿瘤肿块明显小于单独使用MUC1或PSCA定向CAR-T细胞治疗的CAR-T细胞。多项试验正在研究PSCA CAR-T细胞对实体瘤的影响。
Part.3、非小细胞肺癌中的CAR-T细胞疗法的新目标
为了提高CAR-T细胞疗法对NSCLC的疗效,科学家们已经进行了大量研究。目前已经确定了几个靶点正在临床试验中:产促红细胞生成素的肝细胞癌A2(EphA2)、组织因子(TF)和蛋白酪氨酸激酶7(PTK7)。
由于EphA2抗原的分布特点,EphA2是CAR-T细胞疗法治疗NSCLC的一个有前途的靶点。EphA2在90%以上的NSCLC样本中过表达,EphA2表达增加与吸烟史、预后较差和生存率降低相关。一个研究小组开发了一种靶向EphA2的CAR,发现在体外模型中对肿瘤具有特异性细胞毒性,并在体内降低了小鼠的肿瘤信号。
TF也称为凝血因子III,启动凝血级联反应的外在途径,是一种表面分子,已被发现在某些癌症(包括NSCLC)中过表达。NSCLC肿瘤的体外分析发现,TF在侵入血管的肿瘤中表达增加,凸显了其在转移过程中的潜在作用。TF表达增加与总生存期较差相关,体外研究表明使用siRNA敲低TF可抑制肿瘤生长和转移。最近的一项研究开发了针对TF的第三代CAR,发现用TF定向的CAR-T疗法治疗抑制了TF阳性癌细胞的生长和转移,没有明显的毒性。
PTK7是非经典Wnt信号通路中的一种酪氨酸激酶,被认为是NSCLC中CAR-T治疗的潜在肿瘤相关抗原靶点。研究人员发现PTK7靶向CAR-T治疗通过多轮肿瘤攻击是有效的,并且使用体内异种移植小鼠模型,发现抑制了肿瘤生长并增加了总生存期。
Part.4、非小细胞肺癌中的CAR-T细胞疗法的挑战
CAR-T细胞疗法在单次治疗中,很大一部分实体瘤患者成功率较低。通常归因于T细胞浸润到实体瘤微环境中不良和T细胞耗竭。一些微环境可能会使CAR-T细胞完全失活。另一个重大挑战是实体癌中肿瘤抗原表达的异质性。实体瘤中的一些抗原(如EGFR和PSCA)可以在健康组织中表达,从而增加了器官损伤的可能性。
T细胞耗竭是由于反复抗原刺激导致细胞因子分泌减少和抑制性受体上调所致。然后,CAR-T细胞上上调的PD-1受体与肿瘤细胞上的PD-L1受体相互作用增加,导致T细胞功能受到抑制。在小鼠模型中进行的多项研究表明,PD-1破坏的CAR-T细胞具有增强的抗肿瘤功效。人体临床试验目前正在进行中,初步数据显示注射PD-1敲除T细胞是安全的,没有3-5级不良反应,疗效数据仍在收集中。
肿瘤内需要高水平的CAR-T细胞才能实现强烈的抗肿瘤反应。研究表明,使用化疗和放疗可以通过诱导局部炎症状态来增加T细胞浸润到肿瘤中。例如,在NSCLC的体外小鼠模型中,局部放疗后PD-L1 CAR-T细胞对低PD-1表达的肿瘤细胞的疗效增加。增强T细胞渗透到肿瘤中的另一种方法包括使用溶瘤病毒疗法裂解细胞,增加免疫刺激细胞因子的释放。
此外费用问题也是一个巨大的挑战。由于大批量生产的能力有限,CAR-T疗法非常昂贵。由于载体对细胞的固有毒性,生产细胞系中慢病毒载体的生产过程效率相对较低。需要引入嵌合结构的替代方法来增加产量并降低成本。因此CAR-T细胞产品生产的一致性仍有待提高。
再者就是时间问题。CAR-T细胞制造过程通常需要9到14天,包括激活、病毒转导和体外扩增。最近报道了一种制造CAR-T细胞的新方法,该方法可以在24小时内从外周血中提取的T细胞产生CAR-T细胞,而无需T细胞活化或离体扩增。CAR-T细胞的快速制造可以降低生产成本并扩大其适用性。
结 语
CAR-T细胞疗法彻底改变了血液恶性肿瘤的治疗,但CAR-T细胞疗法治疗实体瘤尚未取得可比的成功水平。本篇文章回顾了在实体瘤中实现有效CAR-T细胞疗法所面临的挑战,以及新兴的CAR-T细胞疗法在非小细胞肺癌 (NSCLC) 方面显示出巨大前景。
越来越多的临床试验针对不同类型的表面抗原来研究CAR-T细胞疗法对 NSCLC 的效果,包括表皮生长因子受体 (EGFR)、间皮素 (MSLN)、前列腺干细胞抗原 (PSCA) 和粘蛋白 1 (MUC1)。潜在的新靶点,如产生促红细胞生成素的肝细胞癌 A2 (EphA2)、组织因子 (TF) 和蛋白酪氨酸激酶 7 (PTK7) 目前正在临床试验中进行研究。
希望未来通过更多的研究和临床试验,CAR-T细胞疗法能在非小细胞肺癌 (NSCLC) 以及其他实体瘤治疗上取得更大的进展,造福癌症患者。
参考文献:
Hong Yun Ma , Jeeban Das , Conor Prendergast , et al. Advances in CAR T Cell Therapy for Non-Small Cell Lung Cancer. Curr Issues Mol Biol. 2023 Nov 12;45(11):9019-9038. doi: 10.3390/cimb45110566. PMID: 37998743.
作者:乘黄
内容来源:上海细胞治疗工程技术研究中心