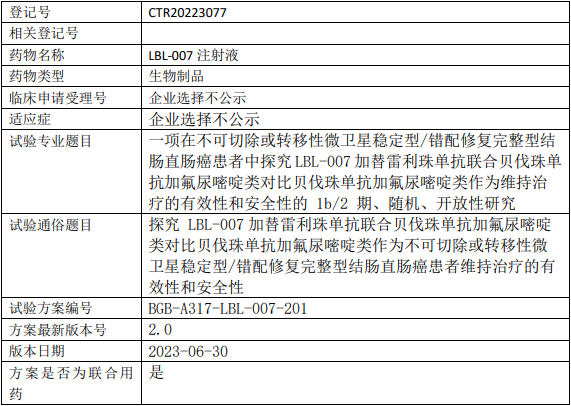
百济神州LBL-007临床试验,探究LBL-007注射液加替雷利珠单抗联合贝伐珠单抗加氟尿嘧啶类对比贝伐珠单抗加氟尿嘧啶类作为维持治疗在不可切除或转移性微卫星稳定型/错配修复完整型结肠直肠癌中有效性和安全性的Ib/II期临床试验
试验目的
Ib期主要目的
评估LBL-007加替雷利珠单抗联合贝伐珠单抗加氟尿嘧啶类的安全性和耐受性。
II期主要目的
通过研究者根据RECISTv1.1评估的PFS,评价LBL-007加替雷利珠单抗联合贝伐珠单抗加氟尿嘧啶类(A组)和贝伐珠单抗加氟尿嘧啶类(C组)在PD-L1阳性(定义为VentanaPD-L1[SP263]检测显示肿瘤面积阳性[TAP]评分≥1%)的不可切除或转移性MSS/pMMRCRC患者中作为维持治疗的有效性。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:1b/2期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、能提供书面知情同意,并理解且同意遵循研究要求和评估计划。
2、在签署ICF时年龄≥18岁(或研究开展地区管辖范围内的法定同意年龄)。
3、患者必须有根据RECISTv1.1标准定义的可测量病灶。
4、患有经组织学检查确认的不可切除或转移性结直肠腺癌(根据美国癌症联合委员会[AJCC]第8版定义的Ⅳ期疾病)。
5、除一线诱导治疗外,既往未接受过针对转移性CRC的全身治疗。注:在全身诱导治疗期间进行局部区域治疗的患者允许入组。
6、患者完成一线诱导治疗,总体缓解达到疾病稳定或更优水平。
排除标准
1、在诱导治疗期间或诱导治疗后研究者认为肿瘤转变为可切除的患者不符合入组条件。
2、一线诱导治疗在任何既往新辅助或辅助化疗或放疗完成后6个月内开始,以后发生者为准。
3、患者在诱导治疗过程中接受了抗EGFR抗体治疗。
4、既往接受过任何靶向T细胞刺激或免疫检查点通路的治疗。
5、患者存在BRAFV600E突变。注:所有患者都需有当地实验室检测的BRAF结果,既往的BRAF检测结果可接受。
6、经当地或中心实验室通过聚合酶链反应(PCR)确认MSI-H阳性状态或免疫组化(IHC)方法确认dMMR状态。可接受并建议使用当地实验室检查结果用于患者入组。注:不缺乏MMR或非MSI-H阳性的CRC肿瘤患者分别被归为pMMR或MSS。