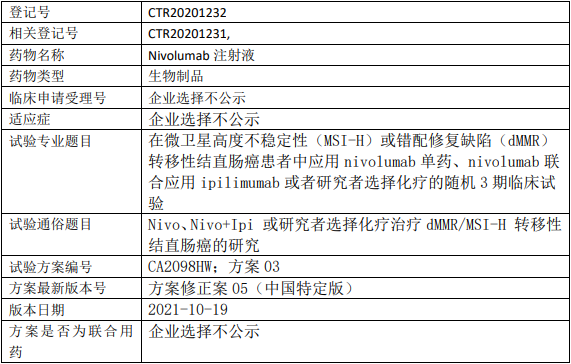
百时美施贵宝纳武利尤单抗临床试验,纳武利尤单抗注射液(Nivolumab、纳武单抗)单药、纳武利尤单抗联合ipilimumab或者研究者选择的化疗治疗微卫星高度不稳定性(MSI-H)或错配修复缺陷(dMMR)转移性结直肠癌的III期临床试验
试验目的
1、旨在dMMR/MSI-HmCRC患者中直接比较Nivo联合应用Ipi或Nivo单药治疗的临床获益,通过PFS、ORR和OS评估。
2、同时在既往未接受过全身性治疗或既往接受过一种全身性治疗的dMMR/MSI-HmCRC患者中,填补免疫治疗与化疗有效性比较的数据空白。
3、数据将支持基于免疫组织化学和核酸体外诊断工具的分析和临床验证,对患者安全、有效使用Nivo和/或Nivo+Ipi联合治疗至关重要。
试验设计
试验分类:有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、经组织学证实为复发性或转移性CRC,针对转移性疾病无化疗和/或靶向药物治疗史且不适合手术。如果疾病进展在完成化疗6个月之后发生(≥6个月),则接受辅助化疗的受试者有资格参加研究。
2、已知肿瘤MSI-H或dMMR状态,符合当地实践标准。
3、所有受试者经CT或MRI检查必须有可测量的疾病(按照RECIST1.1标准)。
4、有足够的肿瘤组织。必须将未染色肿瘤组织切片(至少20张正电荷切片)提交至中心实验室。中心实验室必须在随机化前提供IRT,确认收到可评估肿瘤组织。
5、肿瘤组织样本必须符合以下标准之一:
●在入组3个月内获得以及在采集时间至随机分配期间没有介入性系统性抗癌治疗,且这一组织样本必须是与用于当地MMR/MSI检测相同的组织样本;或
●如果没有上述新鲜样本,则可接受存档组织,但须与当地MMR/MSI检测使用的是同一组织。应采用切除、切口或空芯针穿刺活检。细针穿刺活检是不可接受的。没有软组织成分的脱钙的骨样本的骨病变活检也不能用于提交。
6、ECOG体能状态≤1
排除标准
1、既往抗PD-1、抗PD-L1、抗PD-L2、抗CTLA-4抗体或任何其他特异性靶向T细胞共刺激或免疫检查点通路的抗体或药物治疗,包括既往抗肿瘤疫苗或其他免疫刺激抗肿瘤药物治疗。
2、患有活动性、已知或疑似自身免疫性疾病的受试者。
3、间质性肺病或非感染性肺炎史。
4、已知HIV检测阳性或已知艾滋病病史。
5、随机化14天内,有需要系统性皮质类固醇(>10mg每日泼尼松当量)或其他免疫抑制药物治疗的受试者。在无活动性自身免疫性疾病情况下,允许使用吸入或局部用类固醇和肾上腺替代类固醇,剂量>10mg每日泼尼松当量。
6、研究者认为可能增加参与研究或应用研究药物风险的、损害受试者接受方案治疗能力的或干扰研究结果解释的任何严重或未控制的疾病。未接受过既往系统性治疗或接受过一线系统性治疗的受试者的其他排除标准。
7、在随机化前28天内接受过重大手术、开放活检或有严重创伤。任何与伤口相关的AE必须在随机化前得到缓解。
8、有临床意义的心血管疾病。已有高血压应充分控制。
9、有临床意义的出血倾向或凝血疾病。
10、入组前6个月内发生心肌梗死、动脉血栓形成或脑血管意外。
11、入组前6个月内有胃肠道穿孔或脓肿病史。
12、持续存在的与一线化疗相关的>1级(CTCAEv5.0)毒性(除外脱发、疲劳或周围感觉神经病变,为2级)