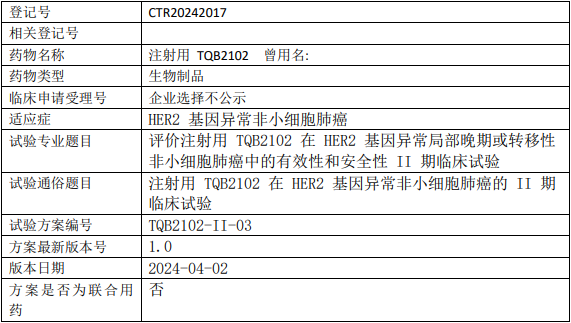
正大天晴药TQB2102临床试验,评价注射用TQB2102治疗HER2基因异常局部晚期或转移性非小细胞肺癌有效性和安全性的II期临床试验
试验目的
评价注射用TQB2102在HER2基因及其他HER家族基因异常非小细胞肺癌中初步有效性、安全性、免疫原性、客观缓解率。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿加入本研究,签署知情同意书,依从性好。
2、年龄:18-75周岁(签署知情同意书时);ECOGPS评分:0~1分;预计生存期超过3个月。
3、根据肺癌TNM分期,局部晚期(ⅢB/ⅢC期)、转移性或复发性(IV期)NSCLC的患者。
4、存在HER2基因异常,或携带EGFR突变。
5、根据RECIST1.1标准至少有一个可测量病灶。
6、育龄女性受试者应同意在研究期间和研究结束后6个月内必须采用避孕措施;男性受试者应同意在研究期间和研究期结束后6个月内必须采用避孕措施。
排除标准
1、合并疾病及病史:
1)治疗前5年内出现过或当前同时患有其它恶性肿瘤;
2)由于任何既往治疗引起的高于CTCAE1级以上的未缓解的毒性反应;
3)治疗前开始前28天内接受过重大外科治疗、切开活检或明显创伤性损伤,7天内经历过创伤性小手术;
4)长期未治愈的伤口或骨折;
5)既往使用类固醇治疗的间质性肺病、放射性肺炎、免疫相关性肺炎病史,或筛选期存在间质性肺病、放射性肺炎、免疫相关性肺炎等间质性改变的活动性非感染性肺炎,存在活动性肺结核,尘肺或患有≥2级其他类型肺炎,或肺功能检查证实肺功能重度受损;
6)治疗前6个月内发生过动脉/深静脉血栓事件;
7)患有≥2级心肌缺血或心肌梗塞、心律失常及≥2级充血性心功能衰竭(纽约心脏病协会(NYHA)分级);需要抗心绞痛药物治疗的心绞痛;具有临床意义的心脏瓣膜病;
8)治疗前14天内存在活动性或未能控制的≥CTCAE2级感染或不明原因的发热>38.5°C;
9)肝硬化、活动性肝炎;
10)肾功能衰竭需要血液透析或腹膜透析者;
11)有免疫缺陷病史;
12)具有精神类药物滥用史且无法戒除或有精神障碍者。
2、肿瘤相关及治疗:
1)在本研究首次给药前28天或5个半衰期内(以较短者为准)的任何抗癌疗法)或任何其他试验性药物治疗;
2)在本研究首次给药前1周内接受过NMPA批准药物说明书中明确具有抗肿瘤适应症的中成药治疗;
3)首次给药前2周内接受局部病灶的姑息性放疗;
4)需反复引流以缓解临床症状的浆膜腔(胸腔、腹腔或心包腔)积液(研究者判断),或在治疗前2周内接受过以治疗为目的的浆膜腔积液引流者;
5)有症状或进行性加重的CNS转移或癌性脑膜炎;
6)肿瘤骨转移所导致的严重骨损伤;
7)无法控制的肿瘤骨转移相关疼痛。
3、研究治疗相关:
1)对人源化单克隆抗体产品(如曲妥珠单抗、帕妥珠单抗等)出现过敏者;
2)对任何研究药物或药物中的任何成分或辅料过敏者;
3)治疗前4周内接受过减毒活疫苗者。
4、根据研究者的判断,有严重危害受试者安全或影响完成研究的伴随疾病者,或认为存在其他原因不适合入组的受试者。