东阳光福瑞赛定临床试验,评价福瑞赛定片治疗慢性已经肝炎的安全性、耐受性、药代动力学特性以及抗病毒活性的I期临床试验
福瑞赛定临床试验简介
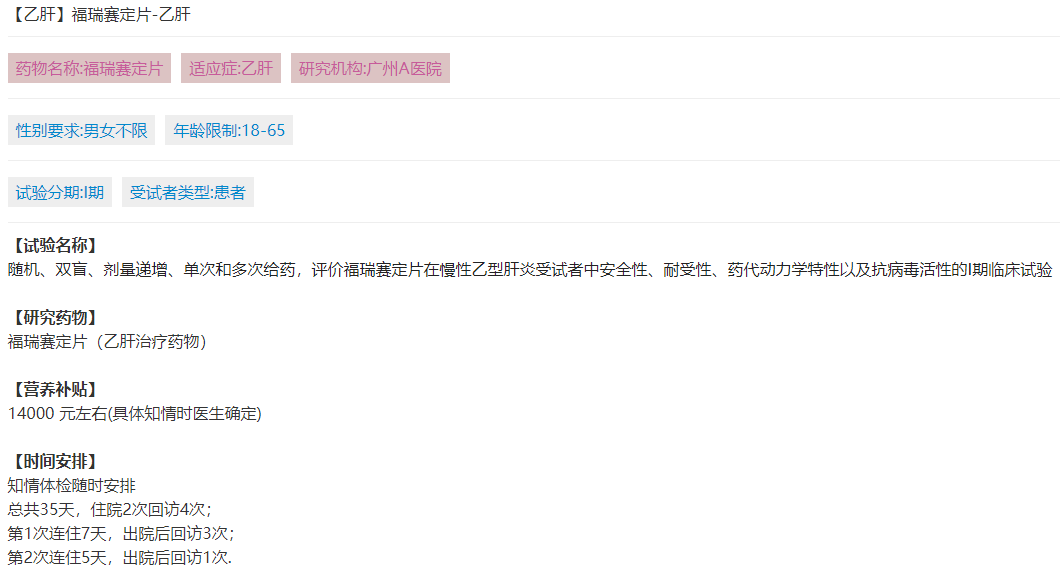
【试验名称】
随机、双盲、剂量递增、单次和多次给药,评价福瑞赛定片在慢性乙型肝炎受试者中安全性、耐受性、药代动力学特性以及抗病毒活性的I期临床试验
【研究药物】
福瑞赛定片(乙肝治疗药物)
【营养补贴】
14000元左右(具体知情时医生确定)
【时间安排】
知情体检随时安排
总共35天,住院2次回访4次;
第1次连住7天,出院后回访3次;
第2次连住5天,出院后回访1次.
试验目的
评价福瑞赛定在健康受试者与慢性乙型肝炎受试者的安全性、耐受性与药代动力学特征以及在慢性乙型肝炎受试者中抗病毒活性
试验设计
试验分类:其他其他说明:安全性、有效性和药代动力学
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:有
出入排标准
【快速筛选】
1.病毒DNA数量大三阳患者2*10的四次方以上,小三阳2*10的三次方以上。
2.六个月内没有服用过抗病毒治疗药物,转氨酶正常也可以
3.HBsAg(乙肝表面抗原)阳性报告;
【入选标准】
1.试验前签署知情同意书,并对试验内容、过程及可能出现的不良反应充分了解;
2.能够按照试验方案要求完成研究;
3.受试者(及其伴侣)愿意自签署知情同意书至最后一次试验用药品结束后3个月内自愿采取有效避孕措施;
4.男性受试者体重不低于50kg、女性受试者体重不低于45kg。BMI=体重(kg)/身高2(m2),体重指数在18~28kg/m2范围内(包括临界值);
【排除标准】
1.试验前3个月平均每日吸烟量多于5支者;
2.过敏体质(多种药物及食物过敏)
3.有酗酒史(酗酒定义为:每周饮用14个单位的酒精:1单位=啤酒285mL,或烈酒25mL,或葡萄酒100mL)
4.尿药筛阳性者或在过去五年内有药物滥用史或使用过毒品者
5.在筛选前3个月内献血或大量失血(>450mL)
6.有吞咽困难或筛选前6个月内有任何影响药物吸收或排泄的胃肠道及肝脏、肾脏疾病史(不论治愈与否)或手术史者
7.患有任何增加出血性风险的疾病,如急性胃炎或胃及十二指肠溃疡等
8.筛选时临床实验室检查有临床意义异常、或筛选前12个月内其它临床发现显示有临床意义的下列疾病(包括但不限于胃肠道、肾、肝、神经、血液、内分泌、肿瘤、肺、免疫、精神或心脑血管疾病)
研究者信息
主要研究者
| 姓名 | 学位 | 职称 | 单位名称 |
| 侯金林 | 医学硕士 | 主任医师 | 南方医科大学南方医院 |
| 牛俊奇 | 医学博士 | 教授 | 吉林大学第一医院 |
| 丁艳华 | 博士 | 教授 | 吉林大学第一医院 |
| 许重远 | 医学博士 | 主任药师 | 南方医科大学南方医院 |
各参加机构
| 序号 | 机构名称 | (主要)研究者 | 省-市(区) | 地址 | 状态 |
| 1 | 南方医科大学南方医院 | 侯金林 | 广东省-广州市 | 广东省广州市广州大道北1838号 | |
| 2 | 南方医科大学南方医院 | 许重远 | 广东省-广州市 | 广东省广州市广州大道北1838号 | |
| 3 | 吉林大学第一医院 | 牛俊奇 | 吉林省-长春市 | 吉林省长春市朝阳区新民大街1号 | |
| 4 | 吉林大学第一医院 | 丁艳华 | 吉林省-长春市 | 吉林省长春市朝阳区新民大街1号 |