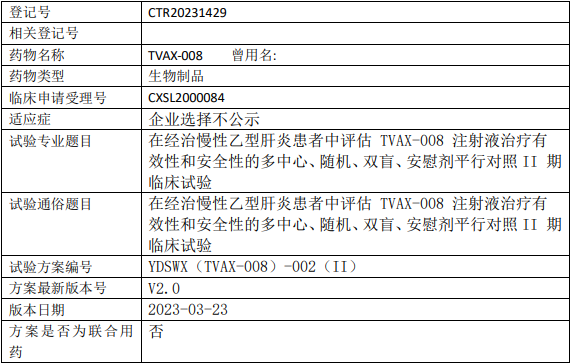
远大赛威信TVAX-008临床试验,评估TVAX-008注射液治疗经治的慢性乙型肝炎有效性和安全性的多中心、随机、双盲、安慰剂平行对照的II期临床试验
试验目的
主要目的
评价TVAX-008注射液治疗核苷(酸)类似物(NAs)经治的慢性乙型肝炎患者的有效性。
次要目的
评价TVAX-008注射液治疗核苷(酸)类似物(NAs)经治的慢性乙型肝炎患者的安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至60岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿签署知情同意书,了解本研究并愿意遵循而且有能力完成所有试验流程;
2、男女不限,年龄18-60岁(包括界值);
3、临床确诊为慢性乙型肝炎(血清HBsAg阳性≥6个月);
4、正在接受富马酸丙酚替诺福韦(TAF)、富马酸替诺福韦酯(TDF)或恩替卡韦(ETV)单一核苷(酸)类似物抗病毒治疗的受试者,且首次使用试验药物前28天内HBVDNA<100IU/mL;
5、首次使用试验药物前28天内HBeAg阴性;
6、首次使用试验药物前28天内HBsAg>10IU/mL且HBsAg<100IU/mL;
7、首次使用试验药物前28天内血清ALT和AST≤5×ULN;
8、抗核抗体(ANA)阴性,或异常但研究者判断不支持自身免疫性肝病的诊断;
9、女性受试者的妊娠检查结果必须呈阴性或经确认处于绝经后状态。有生育能力的女性血清妊娠检查结果必须呈阴性,不得处于哺乳期。必须愿意在签署知情同意书至研究结束内使用高效避孕措施。
排除标准
1、除慢性乙型肝炎外,罹患研究者认为使患者不适合参与研究的临床重要慢性疾病;
2、实验室指标或症状符合以下一项或多项:
1)血磷<0.65mmol/L;
2)血清白蛋白<35g/L;
3)总胆红素>1.5×ULN;
4)血红蛋白<90g/L;
5)凝血酶原时间国际标准化比值INR≥1.5;
6)曾经或目前出现腹水、静脉曲张破裂出血、肝肾综合征、肝性脑病或肝衰竭等;
7)血小板计数<90×109/L;
8)中性粒细胞绝对计数<1.2×109/L;
9)血清肌酐>1.5×ULN或肌酐清除率<50mL/min/1.73m2;
10)影像学结果显示有肝硬化或肝占位病变(肝囊肿或肝血管瘤除外);
3、首次使用试验药物前12周内使用过干扰素或聚乙二醇干扰素治疗,或计划在试验期间使用干扰素或聚乙二醇干扰素治疗;
4、首次使用试验药物前6个月内使用过免疫抑制剂;
5、首次使用试验药物前6个月内持续1周及以上使用过皮质类固醇治疗(外用或吸入皮质类固
6、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)、梅毒螺旋体(TP)抗体或人类免疫缺陷病毒(HIV)抗体阳性;
7、首次使用试验药物前5年内有恶性肿瘤病史或复发史;
8、既往接受过器官移植;
9、有严重的心脏疾病(包括心肌梗死、不稳定性心绞痛、心力衰竭[纽约心脏病协会心功能分级III级或IV级])、肾脏衰竭或胰腺炎;
10、药物控制不稳定的糖尿病(糖化血红蛋白(HbA1c)≥7.5%)或高血压(收缩压≥140mmHg和/或舒张压≥90mmHg);
11、既往严重药物或食物过敏史;
12、既往或目前诊断为精神疾病或严重抑郁症者;
13、首次使用试验药物前30天内或5个药物半衰期内参与了另一项试验药物或生物制剂临床试验;
14、既往1年内使用过试验药TVAX-008注射液的受试者;
15、研究者认为由于其他原因不适合参加本试验。