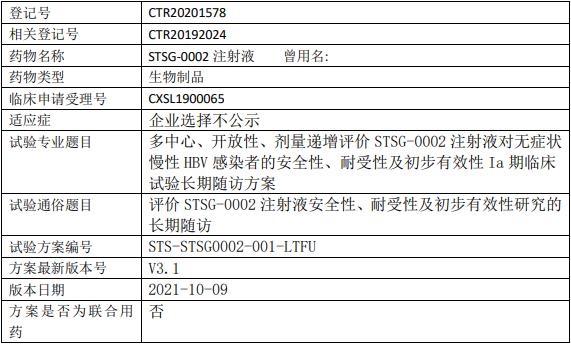
三诺佳邑/舒泰神STSG-0002临床试验,评价STSG-0002注射液安全性、耐受性及初步有效性研究长期随访的I期临床试验
试验目的
评价STSG-0002注射液对无症状慢性HBV感染者的安全性、耐受性、药效动力学(PD)及免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至55岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄:18~55周岁(包括界值),性别不限;
2、BMI:18kg/m2≤BMI≤27kg/m2;
3、生命体征(检测前休息5分钟)无异常,或研究者判断为异常无临床意义;
4、无症状慢性HBV感染者,筛选前至少6个月持续HBsAg(+),无肝病相关症状和体征,血清转氨酶正常,胆红素正常;
5、满足以下标准中任意一条:
5.1受试者HBeAg(+),血清HBVDNA>2×10的8次方IU/mL;
5.2受试者HBeAg(+),血清HBVDNA≥1×10的5次方IU/mL且≤2×10的8次方IU/mL,同时肝组织活检G≤1且S≤1;
5.3受试者HBeAg(-),血清HBVDNA≥2×10的2次方IU/mL且<2×10的3次方IU/mL,HBsAg≤1×10的3次方IU/mL,同时肝组织活检G≤1且S≤1;
6、受试者应在长期随访期间内无育儿计划,并同意采取适当的医学可接受的避孕措施,避免怀孕或使伴侣怀孕;
7、受试者理解试验风险并能够遵守研究方案,自愿参加并签署知情同意书。
排除标准
1、除乙肝以外的其他任何严重的或活动性的疾病,被研究者认为可能会干扰受试者的治疗、评价或对研究方案的依从。包括任何未被控制的具有临床意义的肾脏、心脏、肺脏、血管、神经源性、消化系统、代谢性疾病(糖尿病、甲亢、肾上腺疾病),免疫功能紊乱或肿瘤等;
2、合并感染丙肝(抗-HCV阳性)、HIV、抗-HAVIgM阳性、抗-HDVIgM阳性、抗-HEVIgM阳性、抗-EBVIgM阳性、抗-CMVIgM阳性,自身免疫性肝炎或其他已知或未知原因所致的活动性肝病以及梅毒感染,由研究者根据检查结果综合判断;
3、CHB经治患者,筛选前连续服用乙肝抗病毒药(核苷类药物)超过一个月,或给予试验药物前停药不足6个月;
4、12导联心电图:有临床意义的ECG异常;
5、失代偿期肝病,有以下表现之一者:血清总胆红素>5倍正常值上限或者>85.5umol/L;凝血酶原时间较正常对照延长3秒以上;血清白蛋白<30g/L;有腹水、静脉曲张破裂出血或肝性脑病等病史者;
6、肝纤维化或肝硬化:肝脏弹性检测Fibroscan>9kPa;
7、血清肌酐≥1.5mg/dl(≥130μmol/L);
8、原发性肝癌患者,原发性肝癌高危人群(肝癌家族史、肝脏影像学检查有结节者,如B超显示肝脏内明显占位性病变等),伴或不伴甲胎蛋白(AFP)升高;或者虽无肝癌指征但AFP>50μg/L;
9、筛查前4周内出现急性肝炎,或研究者判断不宜入组的其他感染;
10、筛选期酒精检测或药物检测呈阳性的受试者及结核筛查TB-SPOT阳性;
11、酗酒史(每周饮酒超过14单位酒精,1单位=350mL啤酒或44mL酒精量为40%的烈酒或150mL葡萄酒);
12、有精神疾病病史者;
13、筛查前7天内接种减毒活病毒疫苗;
14、研究用药前6个月内使用过免疫抑制剂、免疫调节剂(胸腺肽α)及细胞毒性药物者;
15、研究者认为受试者依从性差;
16、筛选前3个月内参加过其他药物临床试验;
17、妊娠期、哺乳期妇女;
18、研究者认为不适合参加本试验者。