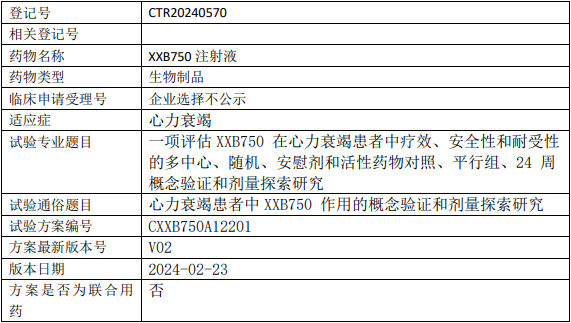
诺华XXB750临床试验,评估XXB750注射液治疗心力衰竭疗效、安全性和耐受性的II期临床试验
试验目的
1、这项II期研究的目的是在纽约心脏病协会心功能分级为II-III级(NYHAII-III级)、正在接受标准治疗(SoC)且左心室射血分数(LVEF)<50%的心力衰竭(HF)患者中,评估不同剂量不同给药方案的XXB750相比安慰剂的疗效、安全性和耐受性;
2、本研究还将比较不同剂量水平的XXB750与转换为沙库巴曲/缬沙坦获得的结果是否相同;
3、本研究的结果将提供设计XXB750III期HF项目所需的信息。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、在参与研究之前必须获得已签署的知情同意书。
2、筛选时≥18岁的男性和女性门诊患者。
3、当前具有NYHAII-III级HF症状。
4、LVEF<50%(使用超声心动图、MUGA、CT扫描、MRI或心室血管造影,可接受在筛选前6个月内或筛选期间在当地进行的最近一次测量结果,且后续无≥50%的测量值)。
5、NT-proBNP≥600pg/mL(如筛选时存在窦性心律)或NT-proBNP≥900pg/mL(如筛选时存在房颤/房扑)。
6、在筛选前接受稳定剂量(至少10mg/天依那普利或等效剂量)的ACEI或ARB至少4周,或在筛选前接受稳定剂量(至少49/51mgbid)的沙库巴曲/缬沙坦至少4周。
7、正在接受研究者认为适当的指南推荐的其他HF治疗,且在筛选前接受稳定剂量治疗至少4周。患者禁忌、不耐受或无法获得此类治疗的情况除外。
排除标准
1、当前患有急性失代偿性HF(慢性HF恶化,表现为可能需要静脉治疗的体征和症状)或筛选前3个月内因HF住院。
2、当前有症状性低血压(例如头晕/晕厥先兆)。
3、筛选或随机化时诊室收缩压(SBP)≥180mmHg或<105mmHg。
4、对XXB750、沙库巴曲/缬沙坦或研究药物的任何辅料或任何其他生物制剂有过敏史。
5、筛选前1年内接受过单克隆抗体或免疫球蛋白类药物。
6、在筛选时使用ACEI/ARB药物的受试者中,既往不能耐受任何剂量的沙库巴曲/缬沙坦(根据研究者的判断)。
7、已知有血管性水肿病史(根据研究者的判断)。
8、筛选时血清钾>5.4mmol/L(或等效血浆钾值)。
9、筛选时根据CKD-EPI公式估计的GFR<30mL/min/1.73m2。
10、筛选时存在已知显著功能性双侧肾动脉狭窄。
11、筛选时存在尿路梗阻或排尿困难的证据,或存在已知对肾功能有影响的先天性肾脏异常。
12、可能是患者HF症状和体征病因的有临床意义的先天性心脏病。
13、研究者认为存在显著血流动力学异常的心脏瓣膜病(二尖瓣功能不全除外)。
14、根据研究者的判断,筛选前6个月内出现具有临床意义的心律失常类疾病(例如室性心动过速)、高度房室传导(AV)阻滞(例如未安装起搏器的情况下发生的莫氏II型和三度房室传导阻滞)或症状性心动过缓。
15、筛选前6个月内患有急性心肌梗死(AMI)或不稳定型心绞痛、有任何缺血性或出血性卒中病史,或者接受过任何经皮冠状血管介入治疗(PCI)或冠状动脉搭桥术(CABG)。
16、筛选时有病史或当前诊断为重度肺病(例如COPD)且需要长期辅助供氧、皮质类固醇或雾化器治疗或需要药物治疗的肺动脉高压(WHOI级或IV级)。
17、筛选时有症状性贫血或血红蛋白<10g/dL(男性受试者)或<9g/dL(女性受试者)。
18、患者既往接受过重大器官移植或有移植意向(即被列入移植名单)。
19、既往或当前诊断有预期寿命少于3年的任何其他疾病。
20、过去3年内接受治疗或未接受过治疗的任何器官系统恶性肿瘤病史,无论是否有局部复发或转移的证据,皮肤的局部基底细胞癌或皮肤鳞状细胞癌或局部前列腺癌除外)。
21、筛选时存在以下任何一种确定的肝脏疾病证据:天门冬氨酸氨基转移酶(AST;血清谷草转氨酶,SGOT)或丙氨酸氨基转移酶(ALT;血清谷丙转氨酶,SGPT)值超过正常值上限(ULN)的3倍,或总胆红素(TBL)>1.5mg/dL。
22、既往或当前诊断有药物滥用或酒精依赖。
23、缺乏理解或遵循说明的能力,或由于研究者认为的任何原因,患者不太可能或无法遵守研究方案。
24、同时参加任何其他试验用药物或器械试验(可以参与非干预性登记研究)。
25、入组时或入组前30天或5个半衰期内(以时间较长者为准)使用其他试验药物。
26、处于妊娠期、哺乳期或计划妊娠(所有有生育能力的女性需要有入组前最多7天内的妊娠试验阴性记录)。有生育能力的女性还需要有使用高效避孕方法的记录(见下文)。有生育可能的女性定义为生理上能够怀孕的所有女性,除非在接受研究治疗期间和末次双盲研究治疗药物注射后3个月内或末次口服研究治疗药物(如果随机接受开放性沙库巴曲/缬沙坦治疗)后7天内使用高效避孕方法。
高效避孕方法包括:
●完全禁欲(如果这符合受试者的首选和惯常生活方式)。定期禁欲(例如,日历法、排卵法、症状体温法、排卵后方法)和体外射精均是不可接受的避孕方法。
●在接受研究治疗前至少6周之前接受了女性绝育术(双侧卵巢切除术(伴或不伴子宫切除术)、子宫全切术、双侧输卵管切除术或双侧输卵管结扎术)。如果仅接受了卵巢切除术,则必须通过跟踪评估激素水平来确认女性的生殖状态。
●筛选前至少6个月女性受试者的男性伴侣绝育(输精管切除术)。对于参与研究的女性受试者,输精管切除的男性伴侣应是其唯一伴侣。
●使用口服药物(雌激素和孕激素)、注射或植入激素避孕或置入宫内节育器(IUD)或宫内节育系统(IUS),或其他等效(失败率<1%)激素避孕方式,例如激素阴道环或经皮激素避孕。如果使用口服避孕药,女性应在接受研究治疗之前稳定使用相同避孕药至少3个月。
如果女性已自然(自发性)停经12个月并具有适当的临床特征(例如适龄的血管舒缩症状史),则视为绝经后女性。如果女性已绝经或在入组研究前至少6周前接受过双侧卵巢切除术(伴或不伴子宫切除)、全子宫切除术、双侧输卵管切除术或双侧输卵管结扎,则认为其没有生育能力。如果仅接受过卵巢切除术,则仅当通过激素水平随访评估确认其生育状态后,才可视为无生育可能。如果当地法规中的避孕方法与上文所列方法存在偏差,则以当地法规为准,并将在ICF中进行描述。