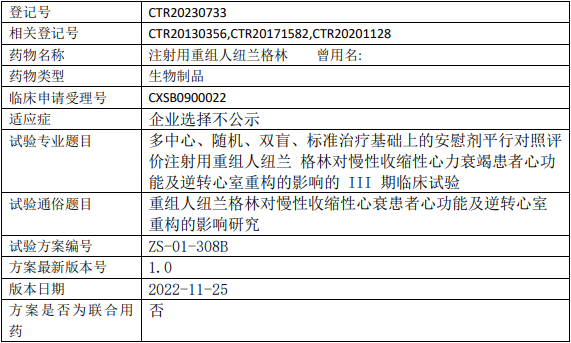
泽生科技重组人纽兰格林临床试验,评价注射用重组人纽兰格林对慢性收缩性心力衰竭患者心功能及逆转心室重构的影响的III期临床试验
试验目的
评价注射用重组人纽兰格林对男性NT-proBNP≤1700pg/ml以及女性NT-proBNP≤4000 pg/ml,纽约心功能分级II-III级慢性收缩性心力衰竭患者的心功能及逆转心室 重构的影响,确证其疗效和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄在18-75周岁,性别不限
2、明确诊断心力衰竭6个月及以上,目前病情稳定,NYHA II-III 级,左心室射血分数(LVEF)≤40%(筛选时心超改良 Simpson’s法测量值≤40%,且基线时CMR测量值≤40%)
3、男性NT-proBNP≤1700 pg/ml,女性NT-proBNP≤4000pg/ml (中心实验室罗氏试剂盒检测);
4、接受心衰标准基础治疗药物满 3 个月,且 1 个月内未改变心衰治疗药物的种类及剂量;
5、理解并签署知情同意书。
排除标准
1、无法接受 CMR 检查,如,安装 CMR 禁忌的起搏器、ICD、CRT 或其他类似装置, 幽闭恐惧症、筛选期内发生房颤、或不能配合 CMR 检测所需的闭气活动;
2、左室流出道梗阻的肥厚性心肌病,缩窄性心包炎,明显并且未经纠正的心脏瓣膜病,心脏瓣膜重度返流或重度狭窄,需手术治疗但未行手术治疗的先天性心脏病,原发 性肺动脉高压或继发性重度肺动脉高压(≥70mmHg),由于肺部疾病所致的右心衰竭;
3、患具有内分泌活性并对心功能或内分泌功能产生影响的增生腺体或腺瘤的患者,如 嗜铬细胞瘤,甲状腺肿大(甲状腺功能正常的甲状腺结节患者不需要排除)等;
4、基线时LVESVi小于135ml/m2;
5、6 个月内准备安装起搏器、ICD、CRT或其他类似装置;
6、有心脏移植史、使用心室辅助装置(VAD)或准备进行心脏移植、VAD;
7、近12个月内诊断围产期或化疗引起的心肌病;
8、近1个月内慢性心衰伴急性血流动力学紊乱或急性失代偿的受试者(症状和体征证明慢性心衰加重,需要静脉用药物治疗);
9、近3个月内发生心绞痛;
10、近6个月内发生心肌梗死、脑血管意外者、血运重建(PCI 或其他手术)、心脏外科手术、颈动脉或其他大血管手术;
11、严重室性心律失常(持续性室速或其他研究者认为需要排除的情况);
12、临床诊断心包积液、胸腔积液或影像显示有心包积液(大于50ml或3mm或少量及 以上)或胸腔积液者(大于200ml或10mm);
13、肝肾功能不全及慢性肝病可能对肝功能有潜在影响者(如慢性肝炎活动期等),非心衰原因胆红素或碱性磷酸酶>2 倍正常值上限,谷草转氨酶和/或谷丙转氨酶>3倍正常值上限,使用 MDRD 方法计算获得的 eGFR<30 ml/min/1.73 m2;
14、收缩压<90mmHg或>160mmHg;
15、血K+<3.2mmol/L 或>5.5mmol/L;
16、2年内有怀孕计划的育龄期女性(育龄期女性定义为所有有怀孕生理能力的女性),怀孕或哺乳期女性;
17、既往有肿瘤病史或现患肿瘤者,或病理检查证实有癌前病变(如乳腺导管原位癌,或子宫颈不典型增生),或通过检查(体格检查、X光检查或B超检查或其他手段)发现体内有恶性肿块的受试者;
18、研究者判断生存期达不到6个月者;
19、前3个月内参加过任何药物临床试验者;
20、严重的神经系统疾病(阿尔茨海默病,帕金森综合征进展期);
21、根据研究者判断,受试者不能完成本研究或不能遵守本研究的要求(由于管理方面的原因或其它原因).