恒瑞医药SHR-1905临床试验,评价单次皮下注射SHR-1905注射液治疗轻度哮喘患者的安全性、耐受性及药代动力学、药效学的I期临床试验
SHR-1905临床试验简介
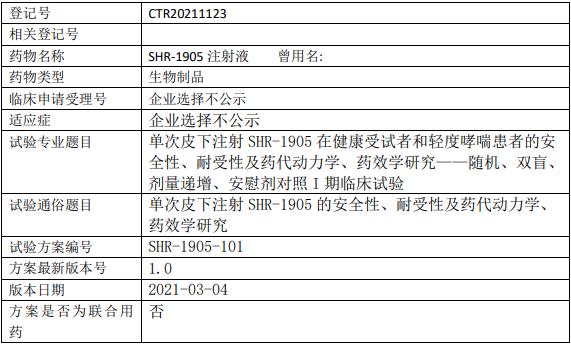
【试验名称】
单次皮下注射SHR-1905在轻度哮喘患者的安全性、耐受性及药代动力学、药效学研究——随机、双盲、剂量递增、安慰剂对照I期临床试验
【适应症】
轻度哮喘患者
【时间安排】
随时预约体检
【申请单位】
上海恒瑞医药有限公司
【受试者获益】
1. 试验期间患者得到免费的研究药物治疗
2. 试验期间提供免费的试验相关检查
3. 试验期间研究医生对患者全程随访与观测
4. 试验期间访视产生的交通费用将给予一定的补助
临床试验信息
1、试验目的
主要研究目的
评估单次皮下注射 SHR-1905 的安全性、耐受性。
次要研究目的
评估单次皮下注射 SHR-1905 的药代动力学(PK)特征和免疫原性。
探索性研究目的
描述单次皮下注射 SHR-1905 的药效动力学(PD)特征。
2、试验设计
试验分类:其他
其他说明:安全性和PK、PD
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至55岁(最大年龄)
性别:男+女
健康受试者:有
出入排标准
入选标准
1.试验前签署知情同意书、并对试验内容、过程及可能发生的不良反应充分了解,能够按照试验方案要求完成研究。
2.签署知情同意书当日年龄必须≥18 周岁且≤55 周岁,男女不限;
3.对于健康受试者,筛选期或基线期体格检查、临床实验室检查(血常规、血生化、尿常规、凝血功能、甲状腺功能)、心电图检查、腹部 B 超、胸片检查正常或异常无临床意义;
4.受试者(包括伴侣)同意在试验期间至最后一次访视采用经医学认可的高效避孕措施(具体避孕措施见附录 1),血清或尿妊娠试验必须是阴性,且为非哺乳期。
5.临床诊断为轻度哮喘患者(轻度哮喘患者还需符合序号 5);
排除标准
1.既往有严重心血管、肝脏、肾脏、消化道、精神神经、血液学、代谢异常等疾病病史;
2. 筛选前 6 个月内有严重外伤或接受过重大手术,或计划在试验期间接受手术者;
3. 筛选期或基线期肾小球滤过率(eGFR)<90 mL/min/1.73m2
4. 筛选时乙型肝炎病毒表面抗原(HBsAg)、人类免疫缺陷病毒抗体(HIV-Ab)、梅毒血清学检查、丙型肝炎病毒抗体(HCV-Ab)阳性;
5. 筛选或给药前收缩压(SBP):SBP>140mmHg 或<90mmhg;舒张压(dbp):dbp>90mmHg 或<60mmHg,且临床医生判断具有临床意义;
6. 筛选或给药前 12-导联心电图结果异常且有临床意义者
7. 基线期酒精呼气测试阳性者;
8. 筛选期烟筛阳性;
9. 基线期尿液药物筛查阳性者;
10. 不适合进行静脉采血者;
11. 对 TSLP 抗体类药物及其辅料过敏者或对其他生物制剂过敏者;
12. 在使用研究药物前 1 个月内使用了任何药物者或使用药物未超过 5 个半衰期者(以较长者为准);
13. 筛选前 3 个月内嗜酒者;
14. 筛选前 3 个月内参加过任何药物或医疗器械的临床试验者或者筛选前仍在某项临床研究的随访期内或试验药物 5 个半衰期内(以较长者为准;
15. 筛选前 1 月内有献血史,或有严重的失血(总血量≥400 mL),或在 2 个月内接受过输血者;
16. 筛选前 1 个月内或者计划在试验过程中接种活(减毒)疫苗者;
17. 轻度哮喘患者包含以下用药史:(轻度哮喘患者还需不符合序号 17)
1.筛选前 4 周内使用 LABA;
2.筛选前 4 周内使用 ICS;
3.筛选前 6 个月内使用抗 IgE/IL-5R/IL-5/IL-4R/TSLP 药物,或使用药物未超过 5 个半衰期者(以较长者为准);
4.筛选前 2 年内使用口服或注射糖皮质激素治疗哮喘
研究者信息
主要研究者信息
姓名:余琛
学位:理学士
职称:主任药师
单位名称:上海市徐汇区中心医院
各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家或地区 | 省(州)-城市 |
| 1 | 上海市徐汇区中心医院 | 余琛 | 中国 | 上海市-上海市 |
| 2 | 广州医科大学附属第二医院 | 叶丽卡 | 中国 | 广东省-广州市 |
| 3 | 深圳市第二人民医院 | 张敏 | 中国 | 广东省-深圳市 |
| 4 | 深圳市第二人民医院 | 吴建龙 | 中国 | 广东省-深圳市 |