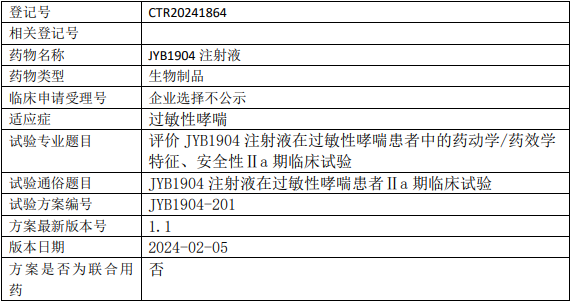
济烨生物JYB1904临床试验,评价JYB1904注射液治疗过敏性哮喘药动学/药效学特征、安全性IIa期临床试验
试验目的
评价JYB1904注射液给药的安全性、药代动力学和药效动力学特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿签署知情同意书。
2、年龄18-75周岁,体重≥40kg,男、女均可。
3、确诊为过敏性哮喘(根据2019年版《中国过敏性哮喘诊治指南》),不限程度。
4、总IgE 81-1000 kU/L,或总IgE 30-80 kU/L且sIgE>0.35 kUA/L。
5、阳性对照组(注射用奥马珠单抗)入选时需要满足其说明书要求的基线总IgE、体重范围。
排除标准
1、入组前1年内接受过靶向IgE相关治疗。
2、入组前8周内接受过或计划在试验期间接受免疫抑制剂、免疫调节剂、全身性糖皮质激素(剂量相当于泼尼松>10mg/天)。
3、既往对抗IgE生物制品类药物具有过敏史。
4、目前吸烟者,或既往吸烟者在入组前戒烟不足1年。
5、合并其他导致IgE升高的非过敏性疾病、变应性支气管肺真菌病。
6、入组前8周内发生过心力衰竭(美国纽约心脏病协会[NYHA]心功能分级≥Ⅲ级)、心肌梗死、不稳定型心绞痛、脑卒中、短暂性脑缺血发作,或入组前8周内接受过心脏相关手术(含冠状动脉旁路移植术、经皮冠状动脉介入治疗),或筛选时合并严重心电图异常(如多形性室速、病态窦房结综合征、无起搏器治疗的三度房室传导阻滞、心率≤50bpm、QTcF≥480ms,以及经研究者评估为严重异常的其他情况)、药物控制不佳的高血压(收缩压≥160mmHg和/或舒张压≥100mmHg)、体位性低血压,或经研究者评估为不适合参加本试验的其他心脑血管疾病。
7、曾患或现患恶性肿瘤、自身免疫性疾病、免疫复合物介导性疾病(如血清病等)、嗜酸性粒细胞增多症。
8、合并需要经静脉药物治疗的感染、酗酒、药物依赖、吸毒、癫痫、痴呆、任何精神类疾病。
9、具有晕血、晕针或静脉采血困难史;或给药部位(左、右侧上臂)存在影响给药或研究者评估的异常皮肤(如皮损、皮疹、纹身等)。
10、入组前8周内失血或献血≥400mL,或计划在试验期间献血。
11、入组前8周内接受过重大手术,或计划在试验期间接受任何手术。
12、符合以下任一标准:血小板<100×10^9/L、谷丙转氨酶≥2.5×ULN(参考值上限)、谷草转氨酶≥2.5×ULN、总胆红素≥1.5×ULN、肌酸激酶≥2×ULN、血肌酐≥1.5×ULN。
13、人类免疫缺陷病毒抗体阳性、梅毒血清学试验阳性、乙型肝炎病毒表面抗原阳性且乙肝病毒DNA>ULN、丙型肝炎病毒抗体阳性且丙肝病毒RNA>ULN。
14、既往接受临床试验在研产品末次给药时间距离入组≤4周(若为治疗用生物制品则≤16周或5个半衰期,以时间长者为准);或入组前尚未退出其他干预性临床试验。
15、妊娠或哺乳期(指分娩后1年内),或女性妊娠试验阳性。
16、有生育能力的受试者自签署知情同意书至末次给药后1年内有生育/冻存或捐献精/卵计划,或不同意采取有效的避孕措施(完全禁欲、屏障法、避孕药、宫内节育器或已行绝育手术)。
17、经评估为不适合参加本试验的其他情况。