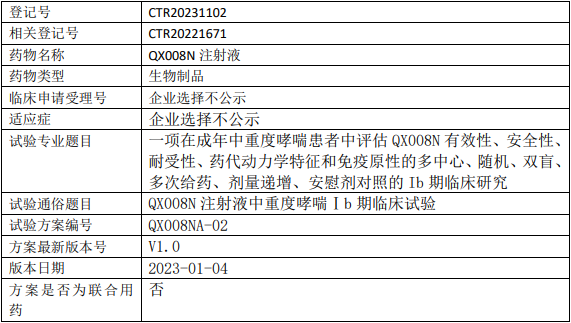
荃信生物QX008N临床试验,评估QX008N注射液治疗成年中重度哮喘有效性、安全性、耐受性、药代动力学特征和免疫原性的Ib期临床试验
试验目的
主要目的
评价QX008N多次皮下注射在成年中重度哮喘患者中的安全性、耐受性。
次要目的
1、评价QX008N多次皮下注射在成年中重度哮喘患者中的有效性、药代动力学(PK)特征及免疫原性特征;
2、为Ⅱ期临床研究推荐合理的给药方案。
探索性目的
评价QX008N多次皮下注射在成年中重度哮喘患者中的药效学(PD)特征。
试验设计
试验分类:安全性
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者充分了解试验目的、性质、方法以及可能发生的不良反应,自愿作为受试者,并签署知情同意书。
2、签署知情同意书时年龄为18~75岁(含界值),男性或女性。
3、体重≥40kg。
4、诊断为哮喘,且病史至少1年。
5、筛选前至少6个月接受中高剂量吸入性糖皮质激素(ICS)治疗,且随机前需稳定使用3个月。
6、联合至少一种其他哮喘控制药物治疗,如LABA、LTRA等,且随机前稳定使用3个月。
7、筛选时40%≤FEV1占预计值%<80%。
8、随机前12个月内有可逆性检测FEV1≥12%和≥200mL记录。
9、随机前ACQ-6评分≥1.5。
10、同意在试验期间以及试验结束后6个月内无生育计划且自愿采取有效避孕措施。
11、受试者能够与研究者良好的沟通并能够依照方案要求完成研究。
排除标准
1、既往接受过同靶点(TSLP)药物者。
2、筛选时仍吸烟或戒烟不满6个月,或既往吸烟量≥10包年。
3、合并免疫缺陷疾病。
4、有证据表明受试者有严重的、进行性的、未控制或不可控制的心血管疾病、神经肌肉疾病、血液系统疾病、除哮喘外的呼吸系统疾病、消化系统疾病、泌尿系统疾病、内分泌或代谢性疾病、神经或精神疾病等。
5、随机前6个月内存在寄生虫感染。
6、筛选前7天内已知有感染(包括慢性或局部感染)者,已知有反复感染史(≥3次/年)并有易发生感染的基础疾病者,播散性单纯疱疹感染或复发性(>1次)或播散性带状疱疹史者,有机会性感染史者。
7、有恶性肿瘤或恶性肿瘤病史(已成功治疗并且5年内无复发转移证据的皮肤鳞状细胞癌,基底细胞癌或局部宫颈原位癌除外)。
8、已知有活动性结核史者,或者筛选时有活动性或潜伏性结核感染者。
9、正在使用或在如下时间内使用过本研究禁止使用的药物:
●筛选前1个月内接种过活疫苗、减毒活疫苗、灭活疫苗、腺病毒载体疫苗,或者计划在试验过程中接种活(减毒)疫苗者;
●筛选前15天内使用LAMA;
●筛选前15天内使用甲磺司特((T2细胞因子抑制剂);
●筛选前15天内使用茶碱类平喘药;
●筛选时使用短效抗胆碱能药物SAMA(如异丙托溴铵);
●随机前12周内接受过以下药物治疗:全身免疫抑制剂/免疫调节药物(如甲氨蝶呤、环孢菌素等),用于哮喘/哮喘急性加重治疗的OCS除外;
●筛选前3个月内接受过免疫球蛋白或其他血液制品;
●筛选前3个月或5个半衰期(以时间较长者为准)内参加过任何药物或医疗器械的临床试验者;
●筛选前3个月或5个半衰期(以时间较长者为准)内使用过任何已上市(如omalizumab,mepolizumab,reslizumab)或即将上市或研究性生物制剂;
●筛选前4周内使用过任何处方药、中草药;
●筛选前2个月内开始进行或计划在研究期间进行过敏原免疫治疗;
10、实验室检查值符合以下任一标准(对于首次检查超出规定值范围的患者可进行二次复查,二次检查结果经研究者判断无异常后可纳入研究):
●血红蛋白<90g/L;
●白细胞计数(WBC)<3.0×109/L;
●中性粒细胞计数<1.5×109/L;
●血小板计数<100×109/L;
●血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)>1.5倍正常值上限(ULN);
●血清肌酐>1.2倍ULN。
11、筛选时乙肝两对半检测HBsAg阳性(若HBsAg阴性,但同时满足:
●抗-HBc阳性、抗-HBs阴性时,需加做HBV-DNA定量检查,检查结果超过正常值范围则排除);
●或丙型肝炎抗体阳性(若抗体阳性,需加做HCV-RNA检测,检查结果超过正常值范围则排除)、梅毒螺旋体抗体阳性(梅毒螺旋体血清学试验呈阳性的受试者需进一步进行非梅毒螺旋体血清学试验,若检测结果为阴性,经研究者判断符合条件的患者可以入选),及HIV抗体检查不能确定为阴性者。
12、既往出现过严重药物、食物过敏反应者,和/或对试验药物或者其中成分过敏者。
13、妊娠或哺乳期女性。
14、研究者认为由于各种原因不适合参加本临床试验者。