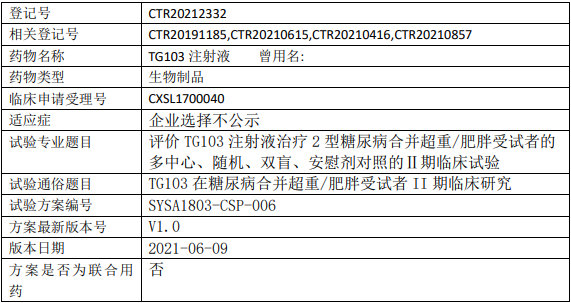
天视珍TG103临床试验,评价TG103注射液治疗2型糖尿病合并超重/肥胖受试者的Ⅱ期临床试验
试验目的
主要研究目的
评估不同剂量TG103注射液在2型糖尿病合并超重/肥胖受试者中控制血糖的有效性。
次要研究目的
1.评估不同剂量TG103注射液在2型糖尿病合并超重/肥胖受试者中控制体重的有效性;
2.评估不同剂量TG103注射液在2型糖尿病合并超重/肥胖受试者中的安全性;
3.评估不同剂量TG103注射液的药代动力学(PK)和药效动力学(PD)特征;
4.评估TG103的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别男+女
健康受试者:无
出入排标准
入选标准
1.符合《中国2型糖尿病防治指南(2020年版)》中关于2型糖尿病的诊断和分类标准者;
2.年龄≥18岁且≤75岁,男女不限;
3.体重指数(BMI)≥24.0kg/m2,按体重指数[BMI=体重(kg)/身高2(m2)];且体重保持稳定(3个月内自述体重变化小于5%);
4.诊断2型糖尿病≤3年,且未使用药物治疗者或筛选前3个月内规律用药史不超过1周者(其中有过用药史的受试者仅包括单药口服用药史及曾有过短期胰岛素强化治疗(≤2周)史者);
5.7.5%≤HbA1c≤10.0%者;
6.有潜在生育能力的受试者在整个研究期间及末次给药后至少3个月内愿意且必须采用可靠的避孕方式以避免女性受试者妊娠或男性受试者伴侣怀孕者;
7.受试者充分了解试验内容与可能出现的不良反应,并有能力与研究人员正常交流,同时遵守研究要求;
8.自愿参加研究并签署知情同意书。
排除标准
1.筛选时FPG≥13.9mmol/L或筛选前6个月内有严重低血糖病史(需要他人帮助治疗的严重事件,伴有意识和(或)躯体改变)者;
2.筛选期收缩压≥160mmHg或舒张压≥100mmHg;
3.抗人类免疫缺陷病毒抗体或抗梅毒螺旋体特异性抗体有一项或一项以上阳性者;
4.筛选时转氨酶(ALT或AST)≥正常值上限的2.5倍,或总胆红素(TBiL)≥正常值上限的1.5倍,或甘油三酯>5.7mmol/L,或eGFR<60mL/(min*1.73m2)者
5.有明显血液系统疾病(如再生障碍性贫血、骨髓增生异常综合征)或任何引起溶血或红细胞不稳定的疾病(如疟疾),或血红蛋白<100g/L者;
6.患有皮质醇增多症、多囊卵巢综合征、甲状腺功能异常(需要药物治疗或筛选前3个月内治疗剂量未达稳定者)等或患有其他可能影响血糖代谢的疾病者;
7.有甲状腺髓样癌(MTC)或2型多发性内分泌肿瘤综合征个人史或家族史,或其他遗传性疾病容易诱导甲状腺髓样癌者,或降钙素≥50ng/L(pg/mL);
8.筛选前3个月内发生过1次及以上或6个月内发生2次及以上糖尿病急性并发症(包括糖尿病酮症酸中毒、高渗性非酮症糖尿病昏迷、乳酸性酸中毒)者;
9.伴有增殖期糖尿病视网膜病变、足部溃疡/坏疽、有明显症状的周围神经病变表现(如胃轻瘫、尿潴留、肠梗阻、尿失禁及痛性周围神经病变等)者;
10.筛选时在未安装心脏起搏器的情况下,12导联心电图出现Ⅱ度或Ⅲ度房室传导阻滞、长QT综合征或QTcF间期延长者(QTcF:男性>450ms,女性>470ms者)或具有显著临床症状的局部缺血性心脏病迹象者;或者患有其他经研究者判定的不宜进入研究的心脏疾病者;
11.筛选前6个月内有任何以下心脑血管事件:需要住院治疗的不稳定性心绞痛、心肌梗塞、冠状动脉旁路移植术、经皮冠脉介入(诊断性血管造影术是允许的)、中重度充血性心力衰竭(NYHAⅢ级或Ⅳ级)、需要住院的心房或心室心律不齐(如:心房颤动、室性心动过速等)、起搏器或除颤器植入、暂时性脑缺血发作或脑血管意外事件(如:中风)者;或在试验中计划进行冠脉搭桥术或血管重建术者;
12.筛选时患有胰腺炎(慢性胰腺炎或急性胰腺炎)或者既往反复出现急性胰腺炎,或血清淀粉酶和(或)脂肪酶≥正常值上限的3倍(如部分中心无法检测脂肪酶,可接受只依据淀粉酶判断);或严重的胃肠道疾病,例如确诊的反流性食管炎或胆囊疾病,或任何影响胃排空(例如胃绕道手术、幽门狭窄,但阑尾切除除外)或有可能会被GLP-1类似物加重病情的胃肠道疾病者;对于既往患有胆囊结石(曾行胆囊结石取石或碎石术)和/或胆囊切除术的受试者,如没有进一步的后遗症,可由研究者评估风险后判断是否能够进入研究;
13.严重的呼吸道、血液系统、中枢神经系统(如癫痫等)等疾病病史;或既往有恶性肿瘤(已经临床治愈的基底细胞癌或原位癌除外)、精神类疾病(如抑郁症、焦虑症等)病史;或有其他可能危及受试者安全的疾病史且研究者认为不适宜入组者;
14.筛选前3个月内接受过重大外科手术,或在筛选前4周内出现过严重或急性感染尚未痊愈者,或筛选期血白细胞总数超出正常值上限的10%;
15.筛选前3个月或预计在研究过程中使用可影响血糖代谢或直接降低胃肠动力的药物,包括累计使用全身性糖皮质激素(皮肤外用、眼内、吸入制剂治疗)、免疫抑制剂、细胞毒类药物超过7天;连续使用7天以上大剂量噻嗪类利尿剂(氢氯噻嗪>100mg/日,氯噻嗪>2g/日,吲达帕胺>5mg/日,氯噻酮>100mg/天)、抗胆碱药、解痉药等;
16.筛选前3个月内服用过可能导致体重减轻的药物(如:奥利司他、西布曲明、利莫那班、苯丙醇胺或氯苯咪吲哚等);或进行了可导致体重不稳定的手术;
17.筛选前3个月内曾经使用或者正在使用可能导致体重显著增加的药物进行治疗,包括三环类抗抑郁药、非典型抗精神病药和情绪稳定剂(如咪唑安定、阿米替林、米氮平、帕罗西汀、苯丙戊酸及其衍生物和锂)等。
18.严重的药物或食物过敏史,或经研究者判断可能会对试验药物过敏者;
19.筛选前3个月内因献血或其他原因失血超过400mL者;
20.筛选前3个月内酒精摄入量平均每周超过21个单位酒精(男性)/14个单位酒精(女性)(1单位≈360mL啤酒,或45mL酒精含量为40%的烈酒,或150mL葡萄酒);
21.筛选前3个月内规律食用咖啡因超过600mg每天(1杯咖啡约含100mg咖啡因,1杯茶约含30mg咖啡因,1罐可乐约含20mg咖啡因)者;
22.筛选前3个月内每天吸烟量大于20支者;
23.给药部位及其半径2cm内有皮炎或皮肤异常等症状者;
24.筛选前3个月内参与了其他药物研究且末次接受试验药物的时间距离此次试验筛选前不满3个月;或受试者在上一次研究中因不良事件出组;或者在本研究期间试图参加其他药物试验者;
25.试验开始前处于妊娠期、哺乳期或妊娠测试血HCG异常且有临床意义者;
26.在筛选前28天内接种过疫苗或计划在整个试验周期内接种疫苗者。
27.研究者判断认为不适合参与本研究者。
研究者信息
主要研究者
姓名:朱大龙
学位:医学博士
职称:主任医师
单位名称:南京大学医学院附属鼓楼医院
各参加机构
| 序号 | 机构名称 | (主要)研究者 | 省-市(区) | 地址 |
| 1 | 南京大学医学院附属鼓楼医院 | 朱大龙 | 江苏省-南京市 | 南京市鼓楼区中山路321号 |
| 2 | 青岛市中心医院 | 姚民秀 | 山东省-青岛市 | 青岛市市北区四流南路127号 |
| 3 | 山东省千佛山医院 | 廖琳 | 山东省-济南市 | 济南市历下区经十路16766号 |
| 4 | 济南市中心医院 | 董晓林 | 山东省-济南市 | 济南市历下区解放路105号 |
| 5 | 山东大学齐鲁医院 | 程梅 | 山东省-济南市 | 济南市历下区文化西路107号 |
| 6 | 中山大学附属第一医院 | 李延兵 | 广东省-广州市 | 广州市越秀区中山二路58号 |
| 7 | 华中科技大学同济医学院附属同济医院 | 余学锋 | 湖北省-武汉市 | 武汉市解放大道1095号 |
| 8 | 十堰市太和医院 | 李雪锋 | 湖北省-十堰市 | 十堰市茅箭区人民南路32号 |
| 9 | 重庆大学附属三峡医院 | 刘维娟 | 重庆市-万州区 | 重庆市万州区新城路165号 |
| 10 | 厦门大学附属中山医院 | 沈兴平 | 福建省-厦门市 | 厦门市思明区湖滨南路201-209号 |
| 11 | 中国人民解 放军联勤保障部队第九〇〇医院 | 陈频 | 福建省-福州市 | 福州市西二环北路156号 |
| 12 | 天津医科大学第二医院 | 郭剑超 | 天津市-河西区 | 天津市河西区平江道23号 |
| 13 | 四川大学华西医院 | 李双庆 | 四川省-成都市 | 成都市武侯区国学巷37号 |
| 14 | 兰州大学第二医院 | 任建功 | 甘肃省-兰州市 | 兰州市城关区萃英门82号 |
| 15 | 邯郸市第一医院 | 王海芳 | 河北省-邯郸市 | 邯郸市丛台区丛台路25号 |
| 16 | 河北医科大学第二医院 | 张力辉 | 河北省-石家庄市 | 石家庄市新华区和平西路215号 |
| 17 | 沧州市中心医院 | 赵永才 | 河北省-沧州市 | 沧州市运河区新华西路16号 |
| 18 | 新疆医科大学第二附属医院 | 路瑶 | 新疆维吾尔自治区-乌鲁木齐市 | 乌鲁木齐市水磨沟区南湖东路北二巷38号 |
| 19 | 新疆维吾尔自治区的人民医院 | 王新玲 | 新疆维吾尔自治区-乌鲁木齐市 | 新疆乌鲁木齐市天池路91号 |
| 20 | 吉林市中心医院 | 赵瑛 | 吉林省-吉林市 | 吉林市船营区南京街4号 |
| 21 | 昆明医科大学第二附属医院 | 柯亭羽 | 云南省-昆明市 | 昆明市五华区滇缅大道374号 |
| 22 | 云南省第一人民医院 | 李蕾 | 云南省-昆明市 | 昆明市西山区金碧路157号 |
| 23 | 贵州医科大学附属医院 | 彭年春 | 贵州省-贵阳市 | 贵阳市云岩区贵医街28号 |
| 24 | 运城市中心医院 | 李平 | 山西省-运城市 | 运城市河东东街3690号 |
| 25 | 郑州大学第二附属医院 | 李青菊 | 河南省-郑州市 | 郑州市金水区经八路2号 |
| 26 | 东南大学附属中大医院 | 王尧 | 江苏省-南京市 | 南京市丁家桥87号 |
| 27 | 大连医科大学附属第一医院 | 杜建玲 | 辽宁省-大连市 | 大连市西岗区中山路222号 |
| 28 | 哈尔滨医科大学附属第四医院 | 成志锋 | 黑龙江省-哈尔滨市 | 哈尔滨市南岗区颐园街37号 |
| 29 | 开封市中医院 | 张芳 | 河南省-开封市 | 开封市顺河回族区财政厅东街54号 |
| 30 | 南京市江宁医院 | 王昆 | 江苏省-南京市 | 南京市江宁区湖山路169号 |
| 31 | 徐州医科大学附属医院 | 凌宏威 | 江苏省-徐州市 | 徐州鼓楼区淮海西路99号 |
| 32 | 嘉兴市第一医院 | 周强 | 浙江省-嘉兴市 | 嘉兴市南湖区中环南路1882号 |
| 33 | 上海市东方医院 | 冯波 | 上海市-浦东新区 | 上海市浦东新区即墨路150号 |
| 34 | 西安大兴医院 | 邢影 | 陕西省-西安市 | 西安市劳动北路353号 |
| 35 | 河北省沧州中西医结合医院 | 王晓蕴 | 河北省-沧州市 | 沧州市运河区黄河路31号 |
| 36 | 自贡市第四人民医院 | 邓春颖 | 四川省-自贡市 | 自贡市自流井区檀木林街19号 |
| 37 | 宜昌市中心人民医院 | 曾朝阳 | 湖北省-宜昌市 | 宜昌市夷陵大道183号 |
| 38 | 吉林大学第二医院 | 蔡寒青 | 吉林省-长春市 | 长春市南关区自强街218号 |
| 39 | 黑龙江中医药大学附属第二医院 | 马国庆 | 黑龙江省-哈尔滨市 | 哈尔滨市南岗区果戈里大街411号 |
| 40 | 复旦大学附属金山医院 | 施晓红 | 上海市-金山区 | 上海市金山区龙航路1508号 |
| 41 | 杭州市第一人民医院 | 张险峰 | 浙江省-杭州市 | 杭州市上城区浣纱路261号 |
| 42 | 应急总医院 | 李洪梅 | 北京市-朝阳区 | 北京市朝阳区西坝河南里29号 |
| 43 | 复旦大学附属中山医院 | 李小英 | 上海市-徐汇区 | 上海市徐汇区枫林路180号 |
| 44 | 秦皇岛市第一医院 | 陆强 | 河北省-秦皇岛市 | 秦皇岛市海港区文化路258号 |