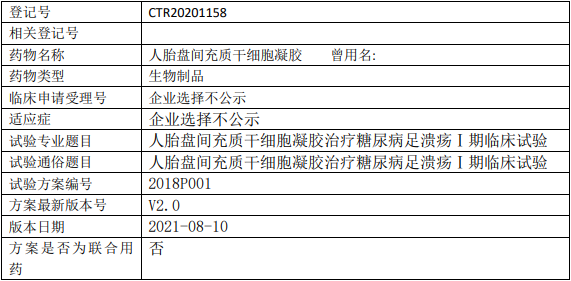
汉氏联合人胎盘间充质干细胞凝胶临床试验,人胎盘间充质干细胞凝胶治疗糖尿病足溃疡I期临床试验
试验目的
1、明确人胎盘间充质干细胞凝胶治疗糖尿病足溃疡患者的耐受性和安全性,确定临床用药安全范围;
2、初步观察人胎盘间充质干细胞凝胶治疗糖尿病足溃疡的有效性,为后续确证性临床试验设计提供依据;
3、探索性观察人胎盘间充质干细胞凝胶治疗糖尿病足溃疡的药代动力学。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:平行分组
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18岁(含)-75岁(含);
2、临床诊断为糖尿病足溃疡, 经综合治疗后Wagner分级为3级或以下;
3、糖尿病足溃疡采用常规治疗方法治疗2周或以上,溃疡无明显好转(溃疡长径或面积缩小≤40%或经研究者综合判定)或继续扩大的患者;
4、外科治疗后拟试验一侧的肢体血液供应正常或仅有轻度缺血,经皮氧分压TcPO2≥30mmHg,踝肱指数(ABI)≥0.71(如ABI≥1.3,则需趾肱指数(TBI)≥0.5);
5、拟试验处溃疡形状较齐整,清创后的溃疡病灶长径≥1.5cm且≤10 cm,或清创后的溃疡病灶面积≥2 cm2且≤30 cm2;如果同时有多个溃疡病灶,选择一个作为试验对象;
6、阅读并充分理解患者须知,同意参加此临床试验,并签署知情同意书。
排除标准
1、妊娠或哺乳期妇女,或临床试验期间及试验结束后6个月内不能采取有效避孕措施或有妊娠计划的妇女;
2、过敏体质,或对试验用药任何成分过敏者;
3、溃疡处病理检测显示有恶性病变,或既往曾有恶性肿瘤病史;
4、溃疡创面与其他病变形成窦道且无法实施清创术;
5、HBV、HCV、HIV病毒或梅毒螺旋体感染者;
6、患有难以控制的严重高血压,收缩压≥160mmHg或舒张压≥100mmHg;
7、血清白蛋白<3.0 g/dL,或血红蛋白<90 g/L;
8、血清ALT或AST>2.5倍正常值上限,或血清Cr>200μmol/L;
9、6个月内有脑卒中、不稳定性心绞痛、心肌梗塞发作史者;
10、有精神分裂症病史或其他严重精神疾病史、药物或酒精滥用史者;
11、3月内参加过其他任何新药临床试验的患者;
12、研究者认为不适合参与本试验的任何其他因素。