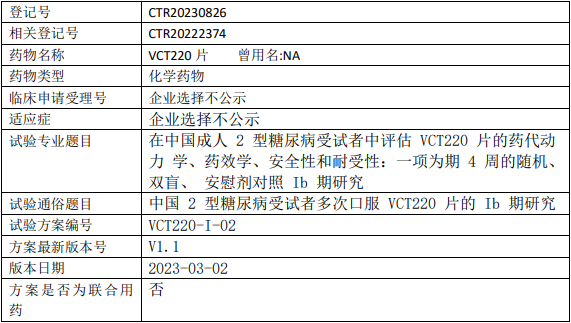
闻泰医药VCT220临床试验,评估VCT220片治疗2型糖尿病的的Ib期临床试验
试验目的
评价仅通过饮食和运动控制血糖的2型糖尿病(T2DM)受试者多次口服VCT220片的安全性、耐受性、药代动力学特征,以及初步探索VCT220片控制血糖的有效性,为后期临床研究提供依据。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至59岁(最大年龄)
性别:男+女健
康受试者:无
出入排标准
入选标准
1、筛选时年龄在18~59岁(含边界值)的中国男性或女性受试者;
2、生活方式干预3个月以上血糖控制不佳的T2DM患者;
3、筛选时评估显示HbA1c≥7.0%且≤10.5%;
4、愿意并且能够遵守所有的计划的访视、治疗计划、实验室检查、生活方式注意事项和其他研究程序的受试者;
5、总体重>50kg,BMI≥19kg/m2且≤34kg/m2,且筛选前3个月内体重稳定(体重变化<5%);
6、受试者在试验期间及试验结束后90天内无生育计划并自愿采取有效避孕措施且无捐精捐卵计划;
7、签署知情同意书。
排除标准
1、存在或既往存在具有临床显著的血液学疾病、肾脏疾病、内分泌疾病、肺部疾病、胃肠道疾病、心血管疾病、肝脏疾病、精神病、神经系统疾病或过敏性疾病(包括药物过敏,但不包括给药时出现的未经治疗的、无症状的季节性过敏);可以纳入患有除2型糖尿病以外的慢性疾病(例如,高胆固醇血症或高血压)但通过饮食或稳定剂量药物治疗得到控制的受试者(例如,可以入选接受适当治疗的高胆固醇血症受试者);
2、任何可能影响药物吸收的情况(例如既往曾行减肥手术、胃切除术或任何肠道区域切除、活动性炎性肠病或胰腺功能异常);
3、诊断为1型糖尿病或特殊类型糖尿病;
4、出现糖尿病急性并发症如酮症酸中毒(DKA)、高血糖高渗状态(HHS)、或乳酸酸中毒病史等,或出现严重糖尿病并发症,如视网膜病变进入增殖期、神经病变有痛性神经病变、血管病变阻塞程度超过50%等;
5、筛选(访视1)前6个月内有心肌梗死、不稳定性心绞痛、动脉血运重建、卒中、纽约心脏协会心功能II-IV级的心力衰竭、短暂性脑缺血发作病史;
6、任何未被视为治愈的恶性肿瘤(皮肤基底细胞癌和鳞状细胞癌除外);注:如果过去5年无癌症复发证据,则视为已治愈。
7、甲状腺髓样癌(MTC)或2型多发内分泌肿瘤综合征(MEN2)的个人史或家族史,或根据研究者判断疑似MTC的受试者;
8、既往或现在患有胰腺炎(慢性胰腺炎或急性胰腺炎病史);
9、急性胆囊疾病;
10、有活动性增殖性视网膜病变和/或黄斑水肿病史;
11、甲状腺功能异常史且筛选时仍需药物治疗,或筛选时TSH超出正常值参考范围;
12、有人类免疫缺陷病毒(HIV)抗体阳性病史、乙型肝炎或丙型肝炎病史;乙型肝炎表面抗原(HBsAg)、乙型肝炎核心抗体(HBcAb)、丙型肝炎抗体(HCVAb)、梅毒螺旋体抗体检测结果阳性;注:允许接种乙型肝炎疫苗。
13、已知对GLP-1受体激动剂不耐受或过敏;
14、可能增加研究参与风险或根据研究者判断可能使受试者不适合参加研究的其他医学或精神疾病,包括近期(过去一年内)或主动自杀意念/行为或实验室检查异常;
15、筛选访视前,在限定的时间内使用了附录5所列的禁用的既往/伴随用药;
16、本研究所用的研究治疗干预首次给药前30天或5个半衰期内(以时间较长者为准)接受过GLP-1受体激动剂;
17、筛选时收缩压≥160mmHg或舒张压≥100mmHg;
18、筛选时12导联ECG显示可能影响受试者安全或研究结果解读的临床相关异常(例如,QTcF间期>450msec、完全左束支传导阻滞(LBBB)、急性或急慢性不明的心肌梗死体征、提示心肌缺血的ST段变化、二度或三度房室传导阻滞或严重的缓慢性心律失常或快速性心律失常)。如果QTcF超过450msec或QRS超过120msec,则应再重复2次ECG,并使用3个QTcF或QRS值的平均值确定受试者的资格;
19、尿液药物检查结果呈阳性;
20、筛选时,临床实验室检查结果显示以下任何异常的受试者(必要时1周内复查确认1次):
AST或ALT水平≥1.5×ULN;
总胆红素水平≥2×ULN;(符合下述要求的已知吉尔伯特综合征除外,即部分胆红素表明结合胆红素<35%总胆红素);
空腹C肽<0.8ng/ml;
淀粉酶或脂肪酶>1.5×ULN;
空腹血糖>270mg/dL(15.0mmol/L);
由CKD-EPI方程计算得出,eGFR<60ml/min/1.73m2;
降钙素≥1.0×ULN;
21、筛选前6个月内经常饮酒超过7标准杯/周(女性受试者)或14标准杯/周(男性受试者)(1标准杯=150ml葡萄酒或360ml啤酒或45ml烈酒);
22、给药前60天内献血量(不包括献血浆)≥500ml;
23、其它研究者认为不适合参加研究的情况。