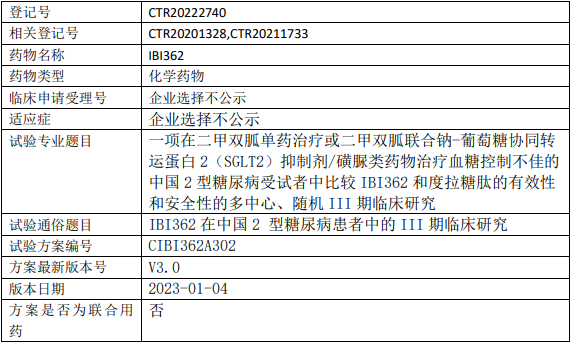
信达生物IBI362临床试验,比较IBI362注射液(Mazdutide、LY3305677)和度拉糖肽治疗二甲双胍单药或二甲双胍联合钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂/磺脲类药物治疗血糖控制不佳的2型糖尿病疗效的III期临床试验
试验目的
验证IBI362组第28周的糖化血红蛋白(glycatedhemoglobinA1C,HbA1c)水平较基线的变化非劣效于度拉糖肽组。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、根据1999年WHO标准确诊T2D
2、签署知情同意书时,年龄≥18周岁
3、筛选前2个月使用稳定剂量二甲双胍(≥1500mg/日),或稳定剂量二甲双胍(≥1500mg/日)联合SGLT2抑制剂(恩格列净10mg/日,达格列净10mg/日,卡格列净100mg/日,恒格列净5mg/日),或稳定剂量二甲双胍(≥1500mg/日)联合日固定剂量磺脲类药物(药物说明书最大剂量的一半)治疗后血糖仍控制不佳,筛选时当地实验室检测7.5%≤HbA1c≤11.0%
4、筛选时BMI≥23kg/m2
5、研究期间可以维持稳定的饮食和运动生活方式
6、受试者自愿签署知情同意书,并同意严格按本方案要求执行
排除标准
1、研究者认为可能对研究药物中成分或同类药过敏的受试者
2、筛选前12周内体重变化>5%(主诉)
3、筛选前2个月内使用过GLP-1R激动剂或GLP-1R/GCGR(glucagonreceptor)激动剂或GIPR(glucose-dependentinsulinotropicpolypeptidereceptor)/GLP-1R激动剂或GIPR/GLP-1R/GCGR激动剂;筛选前2个月以上因为缺乏疗效或不能耐受而停用上述药物的受试者也须排除。筛选前2个月内使用过除背景治疗药物以外的口服降糖药物。筛选前1年内使用过胰岛素控制糖尿病,急性状态短期(累计≤14天)使用胰岛素除外,例如急性疾病、住院期间或择期手术
4、筛选时正在服用中枢神经系统兴奋剂,不包括含咖啡因的饮料
5、筛选前3个月内参加过其他临床试验并已接受试验药物治疗;筛选时存在酒精和药物滥用史
6、既往诊断为1型糖尿病【包含成人隐匿性自身免疫性糖尿病(latentautoimmunediabetesinadults,LADA)】、特殊类型糖尿病或妊娠期糖尿病
7、筛选前6个月内发生过2次及以上酮症酸中毒、糖尿病高渗状态、或乳酸酸中毒。筛选前6个月内有重度低血糖发作病史,定义为出现神经低血糖症状且需要他人协助治疗才能恢复,或既往完全不知道低血糖或对低血糖症状认知不足。研究者认为受试者无法沟通并理解低血糖症状及适当治疗的也应排除该研究
8、既往有胃轻瘫或肥胖外科手术病史,或研究者认为具有临床意义的胃排空异常。既往存在增殖期糖尿病视网膜病变,或糖尿病性黄斑水肿,或非增殖期糖尿病视网膜病变进展较快或需紧急治疗
9、急慢性肝炎,其他肝脏疾病的症状和体征,或ALT>3.0×ULN(非酒精性脂肪性肝病ALT>5.0×ULN),或AST>3.0×ULN,或总胆红素(totalbilirubin,TBIL)>2.0×ULN
10、既往有甲状腺髓样癌、多发性内分泌腺瘤病(multipleendocrineneoplasia,MEN)2A或2B病史或家族史
11、既往明确诊断为自主神经病变,表现为:尿潴留、静息性心动过速、直立性低血压或糖尿病性腹泻
12、筛选前5年内存在活动性或未治疗的恶性肿瘤,或处于临床恶性肿瘤缓解期(皮肤基底细胞癌和鳞状细胞癌、宫颈原位癌、前列腺原位癌或甲状腺乳头状癌术后无复发的受试者除外)
13、特应性反应病史(严重或多种过敏的临床表现)或有临床意义的多个或严重药物过敏史,或对局部糖皮质激素不耐受,或严重的治疗后超敏反应(包括但不限于多形性红斑、线形性免疫球蛋白A皮炎、中毒性表皮坏死松解症、过敏性反应、血管性水肿或剥脱性皮炎)
14、器官移植病史(角膜移植术除外),或正准备接受器官移植
15、既往或筛选时存在精神疾病,研究者认为不适合参加本研究
16、妊娠或哺乳期女性,或具有生育能力且不愿意在整个研究期间避孕的男性或女性
17、研究者认为受试者存在任何可能影响本研究的疗效或安全性评价的其他因素,不适合参加本研究