先为达生物XW003临床试验,XW003注射液治疗在二甲双胍控制不佳的成年2型糖尿病的Ⅲ期临床试验
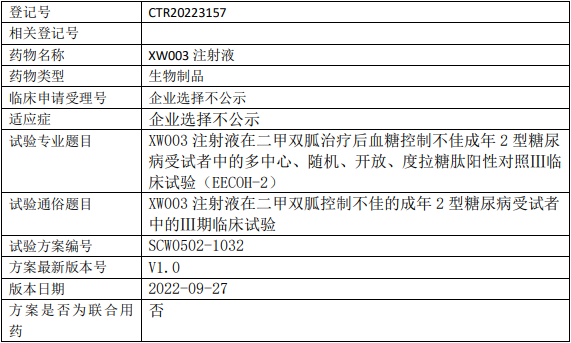
试验目的
在二甲双胍治疗后血糖控制不佳的成年2型糖尿病(T2DM)受试者中评价XW003注射液相对于度拉糖肽注射液治疗32周的疗效差异。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、男性或女性,知情同意时年龄18-75岁(包括界值);
2、符合体重指数(BMI)≥20.0kg/m2且≤35.0kg/m2;
3、符合世界卫生组织(WHO)1999年颁布的糖尿病诊断标准,确诊T2DM至少3个月;
4、筛选前8周内,在饮食运动控制的基础上,仅接受二甲双胍治疗,且稳定接受二甲双胍剂量≥1500mg/天或为受试者最大耐受剂量(不低于1000mg/天),且愿意在试验期间(包括导入期)继续稳定使用;
5、筛选时HbA1c≥7.5%且≤11%(本地实验室)且随机前HbA1c≥7.0%且≤10.5%(中心实验室);
6、筛选时且随机前空腹血糖(FPG)≤13.9mmol/L(本地实验室);
7、对试验目的充分了解,能够和研究者进行良好沟通,并能理解和遵守本项研究规定的各项要求。
排除标准
1、既往诊断1型糖尿病或其他类型糖尿病;
2、既往甲状腺髓样癌(MTC)或2型多发性内分泌肿瘤综合征(MEN2)个人或家族病史;
3、筛选前3个月内,接受医学或非医学性体重管理,包括未经批准的体重管理药物或产品,或筛选前3个月内体重变化幅度超过5%(以受试者自述为准);
4、既往急慢性胰腺炎病史、有症状的胆囊病史、胰腺损伤史等可能导致胰腺炎高风险因素;
5、既往5年内,诊断恶性肿瘤(治愈的皮肤基底细胞癌或宫颈原位癌除外)
6、既往诊断未控制的精神、神经系统疾病;
7、筛选时,乙型肝炎病毒表面抗原[HBsAg]阳性(乙肝肝炎病毒[HBV]脱氧核糖核酸[DNA]定量检测结果低于检测参考范围的下限者除外)、或丙型肝炎病毒[HCV]抗体阳性、或人类免疫缺陷病毒[HIV]抗体阳性者;
8、已知或疑似对GLP-1类药物或辅料过敏的受试者;
9、筛选时,妊娠或哺乳女性受试者,或受试者(包括男性受试者的女性伴侣)自知情同意前1个月内至末次给药后3个月内有生育计划或捐精捐卵计划,或拒绝使用至少一种有效避孕药物或工具进行避孕;
10、可能因为其他原因而不能完成本研究,或经研究者判断具有其它不宜参加试验原因。