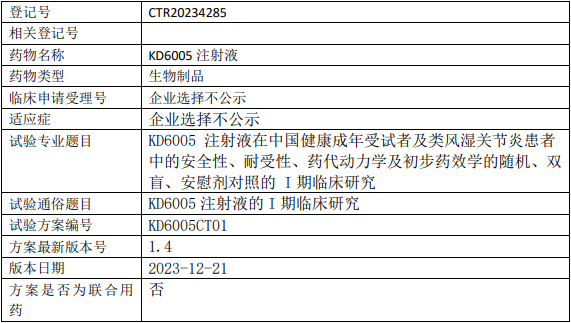
康岱/赛金生物KD6005临床试验,KD6005注射液治疗类风湿关节炎安全性、耐受性、药代动力学及初步药效学的I期临床试验
试验目的
KD6005注射液在中国健康成年受试者及类风湿关节炎患者中的安全性、耐受性、药代动力学及初步药效学的随机、双盲、安慰剂对照的I期临床研究。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:有
出入排标准
入选标准
1、自愿加入研究。
2、健康受试者:
●18岁≤年龄≤50岁,男女均可;
●体重指数在19~26kg/m2(含两端),男性≥50kg,女性≥45kg;
●整体健康状况良好。
3、类风湿关节炎受试者:
●18岁≤年龄≤70岁,男女均可;
●采用1987年或2010年美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)分类标准诊断为类风湿关节炎的患者;
●随机化前如口服糖皮质激素者,需稳定剂量(强的松剂量≤10mg/天)至少4周;
●随机化前如口服非甾体抗炎药(NSAIDs)者,需稳定剂量至少4周。
排除标准
1、已知对本品过敏者。
2、妊娠期、哺乳期妇女。
3、健康受试者:
●过去5年内有恶性肿瘤或淋巴增殖性疾病病史;
●在筛选前3个月内接受过外科手术,或研究期间及研究结束后1个月内计划手术者;
●有影响药物吸收、分布、代谢和排泄的疾病者;
●有临床重大疾病病史,研究者认为可能混淆研究结果或置受试者于不适当的风险之中者;
●结核菌素试验阳性者;
●在筛选前3个月内发生过经研究者判定有临床意义的感染;
●或有结核病史者;
●筛选前3个月内参加献血且献血量≥400mL;
●筛选前3个月内或5个药物半衰期(以较长者为准)参加过任何药物或医疗器械的临床试验者;
●有吸毒或药物滥用史者;
●试验用药品使用前4周内接受过任何药物治疗和保健品者,或试验用药品使用前,既往治疗药物未过5个半衰期,以较长者为准;
●嗜烟、嗜酒者。
4、类风湿关节炎受试者:
●有充血性心力衰竭病史;
●严重的肝、肾等重要脏器和血液、内分泌系统病变及病史者;
●确诊伴有其它风湿免疫系统疾病者;
●在首次研究用药前6个月内,患严重感染、或正处于急、慢性感染期者;
●有恶性肿瘤现病史或既往史;
●3个月内参加过任何药物临床试验者;
●随机前4周内接受过小分子靶向药物;
●乙肝筛查不合格;
●胸部影像学检查和结核菌特异性细胞免疫反应试验提示受试者存在结核感染可能者;
●丙肝抗体阳性者;
●HIV抗体阳性者;
●有抑郁症或自杀想法的精神病患者。