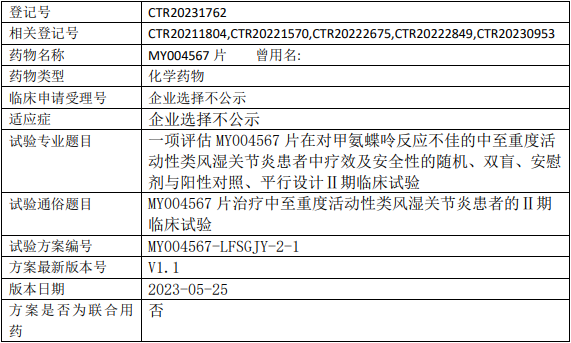
美悦生物MY004567临床试验,评估MY004567片治疗对甲氨蝶呤反应不佳的中至重度活动性类风湿关节炎疗效及安全性的II期临床试验
试验目的
1.以简化疾病活动指数(SDAI)评分为指标,评估口服MY004567片在治疗12周后对甲氨蝶呤反应不佳的中至重度活动性类风湿关节炎患者的疗效;
2.评估口服MY004567片治疗12周内其他疗效指标(详见研究终点)的变化;
3.评估口服MY004567片在对甲氨蝶呤反应不佳的中至重度活动性类风湿关节炎患者中的安全性和耐受性;
4.探索口服MY004567片在对甲氨蝶呤反应不佳的中至重度活动性类风湿关节炎患者中疗效的剂量-反应关系;
5.探索口服MY004567片在对甲氨蝶呤反应不佳的类风湿关节炎患者中的群体药代动力学(PopPK)特征;
6.探索口服MY004567片在对甲氨蝶呤反应不佳的类风湿关节炎患者中的药效动力学(PD)特征及PK/PD的量效关系。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、18-70岁(包含上下限界值),男性或女性。
2、根据2010年美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)分类标准诊断为RA。
3、确诊为中至重度活动性RA,定义为筛选时及随机前,基于68/66个关节计数,有≥6个压痛关节(TJC)及≥6个肿胀关节(SJC),且筛选时红细胞沉降率(ESR)>28mm/h和/或C反应蛋白(CRP)>10mg/L。进行过重大手术治疗的关节或随机前6周内关节内注射过糖皮质激素或透明质酸的关节不计算在TJC和SJC计数内。
4、首次给药前连续使用甲氨蝶呤(MTX)≥12周且口服稳定剂量(7.5~20mg/周)≥4周,以确定受试者对MTX的反应不足,且研究期间能够继续使用稳定剂量的MTX。
5、符合伴随治疗中允许使用的药物标准,详见章节5.5。
6、同意在研究期间至末次给药后3个月内与其伴侣在发生性行为时采用至少一种有效避孕措施者。
7、同意在研究期间至末次给药后3个月内不参加捐精或捐卵行为者。
8、同意签署知情同意书,并承诺遵守研究中各项规定者。
排除标准
1、妊娠期或哺乳期女性受试者。
2、对研究药物或研究药物中的任何成份过敏。
3、患有已知免疫缺陷疾病的受试者或为患有遗传性免疫缺陷患者的一级亲属。
4、筛选时或既往患有除RA、RA继发性干燥综合征外的其他炎性关节疾病或自身免疫性疾病(如痛风、银屑病关节炎、反应性关节炎、脊柱关节炎、系统性红斑狼疮、溃疡性结肠炎、混合性结缔组织疾病等)。
5、免疫功能低下,研究者认为参加试验可能给受试者带来不可接受的风险者。
6、既往使用了以下任何一种药物或治疗:
a)随机前4周内使用过强效阿片类药物,包括(但不限于):羟考酮、羟吗啡酮、芬太尼、左啡诺、丁丙诺啡、美沙酮、氢吗啡酮和吗啡;
b)随机前4周内使用过任何JAK抑制剂药物;
c)除MTX外,随机前使用过其他改善病情抗风湿(DMARDs)或生物制剂:随机前4周内使用过抗疟药(氯喹、羟氯喹等)、柳氮磺吡啶、青霉胺、口服金制剂、环孢素、硫唑嘌呤、环磷酰胺、艾拉莫德等;随机前4周内使用过植物药剂(包括雷公藤制剂、白芍总苷、青藤碱等中成药和/或中草药等);随机前8周内使用过来氟米特;随机前4周内使用过TNF-?抑制剂(融合蛋白类),12周内使用过TNF-?抑制剂(单克隆抗体类)或阿巴西普,10周内使用过托珠单抗,24周内使用过利妥昔单抗,或使用其他生物制剂未超过5个半衰期;
d)随机前4周内和研究期间接受或准备接受关节内、肌肉注射、静脉注射、触发点或压痛点、囊内、或腱鞘内糖皮质激素治疗。
7、对JAK抑制剂治疗反应不佳的患者(定义为治疗8周以上反应不佳)。
8、类风湿关节炎关节功能活动分级为Ⅳ级或需坐轮椅或卧床的患者。
9、有淋巴增殖性疾病病史,或存在提示淋巴增殖性疾病的各种体征或症状,包括异常的淋巴结肿大或肝脾肿大。
10、患有任何急性或慢性活动性感染疾病。
11、有反复发作的带状疱疹(≥2次)、播散性带状疱疹或播散性单纯疱疹病史者,或随机前2个月内有带状疱疹或单纯疱疹病史者,或研究者根据危险因素判断不适合参加试验者。
12、患有活动性结核病者。如果γ-干扰素释放试验(IGRA)检测阳性则由研究者结合病史及临床表现等判断其活动性,确诊为活动性结核病者需排除。潜伏性结核感染者需同时使用异烟肼0.3gqd或其他预防性抗结核治疗,由研究者评估风险后可以筛选入组。
13、既往有血栓性疾病史,包括但不限于静脉血栓栓塞性疾病(如肺血栓栓塞症、深静脉血栓形成)和动脉血栓栓塞性疾病(如急性冠状动脉综合征、动脉缺血发作、脑卒中等),或有任何已知的凝血功能障碍、高凝血症病史,或经研究者判断血栓形成风险可能增加的受试者。
14、随机前4周内接种过活/减毒疫苗或计划在试验期间接种活/减毒疫苗者。
15、筛选期或基线时查心电图有显著临床意义的异常。
16、筛选期时行实验室检查有显著临床意义的异常,包括但不限于以下情况者:血碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转移酶(GGT)、总胆红素(TBIL)、肌酐(Cr)>正常上限(ULN)的2倍;
17、既往5年内曾患有恶性肿瘤病史者(现病情稳定且已接受合适治疗或切除的非转移性皮肤基底细胞或鳞状细胞癌、原位癌除外)。
18、既往曾接受包括但不限于:胃切除术、胃成形术、任何类型的减肥手术、迷走神经切断术或肠切除术等可能影响药物吸收的任何情况者。
19、既往患有严重心血管系统、消化系统、呼吸系统、神经系统或泌尿系统等经研究者判断不适合参加试验者。
20、既往1年内有酗酒或药物滥用史者。
21、既往或目前正患有重大精神障碍病史者。
22、筛选前3个月内曾参加过其他药物临床试验,或本研究首次服药日仍在上一个药物临床试验规定的安全性洗脱期内者。
23、筛选期有活动性乙型肝炎、活动性丙型肝炎、人体免疫缺陷病毒(HIV)感染、梅毒感染者。
24、根据研究者的判断,在研究期间不能遵循本研究中伴随治疗的各项限定规则者或存在其他可能增加受试者风险、影响研究结果、干扰其参加整个研究过程的因素,包括但不限于生命体征、体格检查、心电图和/或临床实验室检查等异常者。