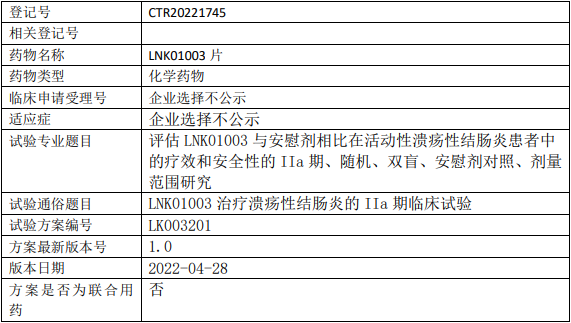
凌科药业LNK01003临床试验,LNK01003片治疗溃疡性结肠炎的IIa期临床试验
试验目的
主要目的
1、评估LNK01003在活动性溃疡性结肠炎成年受试者中的安全性和耐受性。
2、评估LNK01003在活动性溃疡性结肠炎成年受试者相比基线时改良Mayo评分的变化。
次要目的
1、评估LNK01003治疗活动性溃疡性结肠炎成年受试者达到临床缓解、症状缓解、内镜缓解、临床应答的受试者百分比。
2、评估试验期间C-反应蛋白(CRP)和粪钙卫蛋白相比基线的变化。
3、评估LNK01003的血浆、粪便药代动力学(PK)特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者必须提供书面知情同意,包括遵循知情同意书和本方案列出的要求和限制。
2、年龄在18~65周岁(包含边界值),性别不限。
3、诊断为溃疡性结肠炎(UC)。
4、存在活动性溃疡性结肠炎。
5、受试者必须愿意在指定的时间点接受结肠镜检查。
6、经研究者证实受试者至少一种治疗存在应答不足、失去应答或不耐受。
7、育龄期女性及男性受试者在研究期间至末次研究用药后3个月内,必须采用高效的避孕措施(如禁欲、口服避孕药、宫内节育器、有杀精剂的屏障避孕、手术绝育);男性受试者的配偶或伴侣为有生育能力的女性,男性受试者也必须同意在研究过程中至末次给药后的3个月内采取适当的避孕措施,且在这期间男性受试者不会捐献精子。具有生育能力的女性受试者妊娠试验必须为阴性(无生育能力是指已停经至少2年或者已接受子宫全切除术、双侧输卵管结扎术或双侧输卵管切除术和/或双侧卵巢切除术,或患有先天性不孕的女性受试者)。
排除标准
1、对研究药物组分(及其辅料)和/或其它同类产品存在变态反应或显著过敏的病史。
2、受试者当前患有可疑的或确诊的克罗恩病、未定型结肠炎、缺血性结肠炎、暴发性结肠炎、中毒性巨结肠、辐射线结肠炎、结肠炎相关的憩室疾病或肠结核。
3、受试者既往或当前存在胃肠道异型增生。
4、受试者随机前60天内有艰难梭菌感染或30天内有其它肠道感染的证据或治疗史。
5、受试者既往接受过JAK抑制剂治疗。
6、受试者在随机前30天内或5个药物半衰期内(以时间较长者为准)接受过任何非生物制剂。
7、受试者在基线前30天内接受过传统中药治疗。
8、受试者在随机前30天内出现需要静脉注射抗感染药物治疗的活动性感染或在随机前14天内出现需要口服抗感染药物治疗的活动性感染。
9、根据研究者的临床评估,受试者存在导致不适合参加本研究的慢性复发性感染。
10、受试者目前存在复发性或播散性(即使仅发生过一次)带状疱疹,或存在既往病史。
11、受试者目前存在播散性(即使仅发生过一次)单纯疱疹,或存在既往病史。
12、受试者存在HBV、HCV或者人免疫缺陷病毒(HIV)感染。
13、受试者在筛选访视前5年内有任何活动性恶性肿瘤或恶性肿瘤病史。
14、受试者存在胃肠道穿孔(阑尾炎或穿透伤除外)、憩室炎的病史,或者研究者判定受试者出现胃肠道穿孔的风险显著增加。
15、目前患有或既往存在重度、进展性或未控制的肾脏、肝脏、血液、消化道、代谢、内分泌、肺脏、心脏、神经疾病史或有血栓栓塞疾病病史的受试者。
16、随机前3个月内做过重大的胃肠道手术(不包括阑尾切除术或胆囊切除术),如曾接受过广泛结肠切除术,次全或者全结肠切除术,或计划进行肠道手术。
17、受试者存在结肠镜检查的禁忌症,包括但不限于胃肠道瘘管、腹部手术后早期、严重的凝血功能障碍、腹部大动脉瘤或任何经研究者判断显著增加结肠镜检查并发症风险的情况。
18、受试者患有任何可能影响药物吸收的疾病,包括但不限于短肠综合征。或受试者不能遵守本方案要求,包括无法口服药物;或研究者认为可能对本研究结果评价产生干扰或影响受试者安全性的情况,包括受试者因UC可能需要在研究期间手术。
19、随机前6个月内受试者存在具有临床意义(根据研究者的判定)的药物滥用史或酒精滥用依赖史。