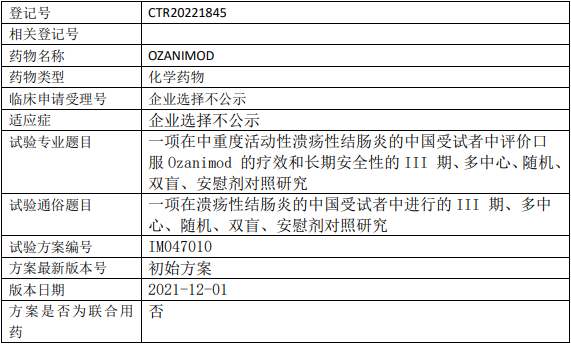
百时美施贵宝奥扎莫德临床试验,评价口服盐酸奥扎莫德胶囊(Ozanimod)治疗中重度活动性溃疡性结肠炎疗效和长期安全性的III期临床试验
试验目的
在中国中重度活动性溃疡性结肠炎(UC)受试者中评价ozanimod与安慰剂相比的疗效和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者在研究药物首次给药前至少3个月诊断为中重度活动性UC。应通过临床和内镜检查证据确诊,并得到组织病理学报告的证实。
2、根据基线内镜检查确定受试者存在UC延伸至距肛门边缘≥15cm的证据。
3、受试者患有活动性UC,定义为四组分Mayo评分为6-12分(含),其中内镜检查分项评分≥2,直肠出血评分≥1,且排便频率评分≥1。
4、受试者目前必须接受至少一种以下治疗,受试者必须在诱导期间继续这些治疗:
i)在筛选内镜检查前接受用于治疗UC的稳定治疗剂量的口服氨基水杨酸至少2周;
ii)在筛选内镜检查前接受稳定剂量的泼尼松龙(剂量≤20mg/天)或等效剂量的药物至少2周;
iii)筛选内镜检查前接受稳定剂量的布地奈德MMX治疗至少2周。
5、受试者接受过结肠镜检查:
i)如果受试者的左侧结肠炎病程>12年或全/广泛性结肠炎病程>8年,在过去2年内接受的结肠镜检查来筛查异型增生;
ii)如果受试者年龄>45岁,在过去5年内接受的结肠镜检查来筛查息肉。
6、如果近期已停用口服氨基水杨酸盐或皮质类固醇,则受试者必须在用于基线Mayo评分的内镜检查前已经停用至少2周。
7、随机化前至少30天,必须有记录的水痘带状疱疹病毒(VZV)免疫球蛋白G(IgG)抗体阳性或完成VZV疫苗接种。
8、受试者必须为中国男性或女性,签署知情同意书时年龄为18-75岁(含)。
9、研究者应告知有生育能力的女性(WOCBP)受试者以及与WOCBP有性生活的男性受试者避孕的重要性和意外妊娠的影响;研究者应根据研究治疗首次给药评价避孕方法的有效性;当地法律和法规可能要求使用替代和/或额外的避孕方法。
10、只有满足以下标准之一时,受试者才有资格入组OLE期:
1)受试者必须完成第10周访视,并且在第10周时为无应答者;
2)完成诱导期并进入维持期,在维持期出现疾病复发的受试者;疾病复发定义为满足以下所有标准:UC疾病活动度增加,定义为部分Mayo评分较第10周部分Mayo评分增加≥2分,并且部分Mayo评分绝对值≥4分内镜检查分项评分≥2分排除与基础UC无关的疾病活动度增加的其他原因;
3)在第52周完成维持期的受试者可以选择参加OLE。
排除标准
1、受试者患有重度广泛性结肠炎,证据为:
i)医生判断受试者可能需要在基线后12周内进行结肠切除术或回肠造口术;
ii)当前或近期有暴发性结肠炎、中毒性巨结肠或肠穿孔的证据。
2、受试者诊断为CD或不确定的结肠炎,或存在符合CD或显微镜下结肠炎或放射性结肠炎或缺血性结肠炎的瘘管史。
3、筛选时受试者的粪便病原体检查结果呈阳性或产毒素艰难梭菌检测结果呈阳性;可使用粪便艰难梭菌聚合酶链反应(PCR)检查排除假阳性;如果为阳性,可对受试者进行治疗和复检;要求在诱导期第1天的前60天内记录病原体的阴性检测结果。
4、受试者处于妊娠期或哺乳期,或在筛选期间测得血清β-人绒毛膜促性腺激素(β-hCG)阳性。
5、受试者患有临床相关的肝、神经、肺、眼科、内分泌、精神或其他重大全身性疾病,使得难以实施或理解方案,或参与研究将使受试者处于风险中。
6、受试者患有临床相关的心血管疾病,包括既往或当前存在以下情况:
i)近期(筛选前6个月内)发生过心肌梗死、不稳定型心绞痛、卒中、短暂性脑缺血发作、需要住院的失代偿性心力衰竭、III/IV级心力衰竭、病态窦房结综合征或未经治疗的重度睡眠呼吸暂停;
ii)Fridericia校正QT间期延长(QTcF;男性QTcF>450ms,女性>470ms),或存在QT间期延长的额外风险;
iii)在筛选时将生命体征作为体格检查的一部分测量时,静息HR<55次/每分钟(bpm)。
7、受试者有1型糖尿病史,或未控制的2型糖尿病且糖化血红蛋白(HbA1c)>9%,或糖尿病受试者有重大合并症,如视网膜病变或肾病。
8、受试者有葡萄膜炎或黄斑水肿病史。
9、受试者有癌症病史,包括实体瘤和血液系统恶性肿瘤或结肠黏膜不典型增生
10、受试者在随机化前1年内有酒精或药物滥用史
11、受试者有原发性或继发性免疫缺陷病史或目前有活动性原发性或继发性免疫缺陷。
12、哺乳期女性
13、使用方案排除标准中定义的既往/合并治疗
14、已知受试者患有活动性细菌、病毒、真菌、分枝杆菌感染或其他感染或在筛选前30天内需要住院或静脉注射(IV)抗生素治疗或在筛选前14天内口服抗生素的任何重大感染事件。
15、受试者有复发性或慢性感染史或已知存在复发性或慢性感染、允许复发性尿路感染进入本研究。
16、在既往发生重度急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染的情况下,症状必须已完全缓解,并且经过研究者评估,与临床研究医师/医学监查员协商,不存在使受试者接受研究药物治疗的风险更高的后遗症。
17、受试者的实验室检查结果如下:
a)血清肌酐:女性>1.4mg/dL或男性>1.6mg/dL;
b)肝功能损害或天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)持续升高>2×正常值上限(ULN),或直接胆红素>1.5×ULN;
c)血小板计数<100,000/μLd)血红蛋白<8.0g/dL;
e)中性粒细胞<1,500/μL;
f)绝对白细胞计数<3500/μL;
g)绝对淋巴细胞计数<800/μLh)ECG显示任何有临床意义的异常。
18、有任何重大药物过敏或不耐受史。
19、OLE排除标准:
1)自诱导期或维持期首次研究药物给药后,受试者接受了以下任一治疗:
a)使用生物制剂或托法替尼;
b)使用除ozanimod以外的研究药物;
2)受试者目前正在接受或需要在诱导期或维持期开始以下任一治疗:
a)使用皮质类固醇激素,泼尼松龙剂量>40mg或等效剂量;
b)使用抗肿瘤药、免疫抑制剂;
c)长期使用NSAID;
d)使用Ia类或III类抗心律失常药物治疗或使用已知可延长PR间期的2种或2种以上药物联合治疗。