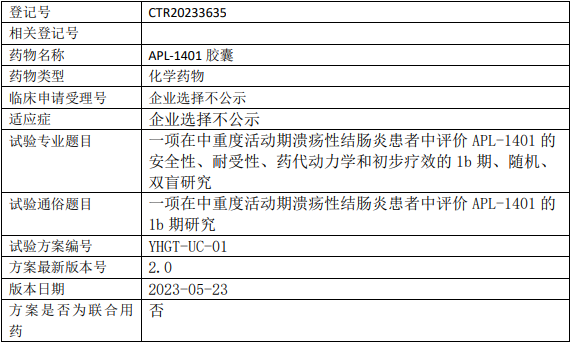
亚虹医药APL-1401临床试验,评价APL1401治疗中重度活动期溃疡性结肠炎安全性、耐受性、药代动力学和初步疗效的Ib期临床试验
试验目的
主要目的
1.评价ALP-1401在中重度活动期溃疡性结肠炎(UC)患者中的安全性;
2.考察APL-1401在UC患者中的药代动力学(PK)特征。
次要目的
1.收集APL-1401在中重度活动期UC患者中的初步疗效信号;
2.探索APL-1401在UC患者中产生治疗应答的生物标志物。
试验设计
试验分类:其他其他说明:安全性、药代动力学、耐受性和初步疗效
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、愿意并能够提供书面知情同意书。
2、年龄为18-65岁(含)
3、至少在筛选前3个月被诊断为UC。
4、目前患有活动期UC,定义为基线时Mayo总分为6至12(含),经研究中心阅片员确认的Mayo内镜子评分(MESS)≥2。
5、除筛选期间的MESS≥2外,便血评分≥1且排便频率评分≥1。
6、可能正在接受以下药物:
a)口服5-氨基水杨酸盐(5-ASA)类药物(美沙拉嗪、奥沙拉嗪、巴柳氮、柳氮磺吡啶),前提是在随机化前处方剂量已稳定至少4周;治疗期间剂量必须稳定;
b)口服皮质类固醇治疗(泼尼松处方剂量稳定≤30mg/天或其与其等效剂量的其他口服皮质类固醇),前提是随机化前处方剂量已稳定至少2周;在治疗期间,可维持相同剂量,但研究者可逐渐减量。
7、有生育能力的女性在筛选访视时的妊娠试验结果必须为阴性,并同意在整个研究期间同时使用2种高效避孕方法
8、男性受试者必须同意从筛选访视至末次给药后3个月内使用研究方案规定的避孕方法
排除标准
1、患有暴发性结肠炎、中毒性巨结肠、原发性硬化性胆管炎、克罗恩病、结肠炎相关结肠发育不良病史、活动性胃溃疡疾病。
2、目前存在具有临床意义的细菌、寄生虫(和/或虫卵)、真菌或病毒感染。
3、以下任意一项检测结果呈阳性:乙型肝炎、丙型肝炎、人类免疫缺陷病毒(HIV)、结核病
4、使用以下任何药物:
a)随机化前1周静脉注射皮质类固醇;
b)随机化前2周局部使用5-ASA化合物或外用类固醇(即灌肠剂或栓剂);
c)随机化前2周使用止泻药物;
d)随机化前9周,使用1-磷酸鞘氨醇受体(S1PR)调节剂(包括但不限于奥扎莫德);
e)随机化前4周使用JAK抑制剂,包括但不限于托法替布和乌帕替尼;
f)随机化前10周使用TNF-α拮抗剂,包括但不限于英夫利西单抗、阿达木单抗、戈利木单抗、培塞利珠单抗或其他生物类似制剂;
g)整合素拮抗剂,包括但不限于筛选前18周使用维得利珠单抗和筛选前10周使用natalizumab;
h)筛选前14周使用白介素拮抗剂,包括但不限于乌司奴单抗;
i)接受以下任何药物治疗的患者,如果未在随机化前至少2周停用:硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤、吗替麦考酚酯、环孢素、他克莫司、西罗莫司、沙利度胺;
j)禁用的合并用药见方案第6.5.2节表1。
5、筛选前30天内参加过另一项试验药物(或医疗器械)临床试验的受试者,或正在参加另一项试验药物(或医疗器械)研究的受试者。
6、实验室检查(血常规、血生化、TSH、总T3、游离T4、尿常规)存在具有临床意义的异常。
●肝功能检查(ALT、AST或总胆红素)>2x正常值上限(ULN);
●肌酐清除率估计值<60mL/min(使用Cockcroft-Gault公式计算);
●促甲状腺素(TSH)<2.5mIU/L或>4.2mIU/L。
7、静息心率(HR)<50bpm或>120bpm。
8、静息收缩压>160mmHg或<90mmHg,静息舒张压>110mmHg或<60mmHg。
9、有甲状腺疾病或甲状腺手术史或正接受甲状腺药物治疗
10、有体位性低血压(从仰卧位到站立位时收缩压降低>20mmHg或舒张压降低>10mmHg)或存在有临床意义的体位性头晕病史。
11、有III级或IV级充血性心力衰竭,根据纽约心脏协会(NYHA)功能分类或任何最近发生的心力衰竭导致NYHAIII/IV级症状。
12、过去6个月有急性冠状动脉综合征(如心肌梗死、不稳定型心绞痛)。
13、在接受Ia类或III类抗心律失常药物治疗,或在联合使用两种或两种以上已知可延长PR间期的药物进行治疗。
14、在合并使用β受体阻滞剂(包括但不限于眼科用噻吗洛尔)、利血平、可乐定、单胺氧化酶(MAO)抑制剂、α受体阻滞剂、可增强儿茶酚胺生成的血管扩张剂(肼屈嗪和硝酸盐)或N-乙酰转移酶的底物或抑制剂。
15、首次给药前至少3个月内有酒精滥用或酒精依赖,至少出现美国精神病协会精神疾病诊断和统计手册第五版(DSM-V)酒精使用障碍评价标准症状中的2项。
16、有药物相关皮疹病史或曾发生有临床意义的皮疹或瘙痒。
17、COVID-19重症感染且需要使用呼吸机或其他导致无法使用研究药物的治疗。
18、中度至重度(Child-PughB级和C级)肝功能损害。
19、筛选前5年内直至首次给药,有恶性肿瘤病史,但以下情况除外:
a)接受过出于治愈目的的治疗、且在首次药物给药前>5年内未接受治疗、且处于缓解状态的任何恶性肿瘤患者为合格患者;
b)在首次药物给药前任何时间接受过根治性治疗的皮肤基底或鳞状细胞癌或者宫颈原位癌且无复发证据的患者为合格患者。