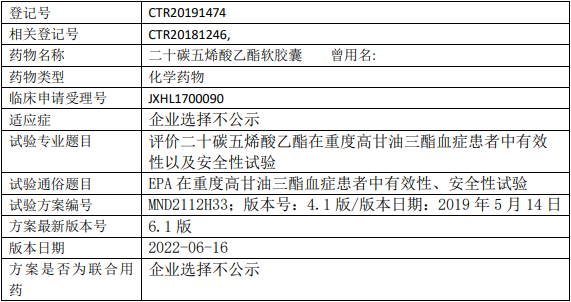
住友制药二十碳五烯酸乙酯临床试验,二十碳五烯酸乙酯软胶囊治疗重度高甘油三酯血症有效性、安全性的III期临床试验
试验目的
考察二十碳五烯酸乙酯在中国重度高TG血症患者中的有效性及安全性。
(1)有效性试验药服药12周后较服药前的血清TG变化率
(2)安全性给药期间出现的不良事件
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、-6周~-4周的血清TG值(空腹时)≥5.65mmol/L(500mg/dL),<22.60mmol/L(2000mg/dL)的患者
2、正在接受生活习惯改善指导,且研究者判断,能够在整个临床试验期间遵守生活习惯改善指导的门诊患者
3、性别不限、签署知情同意书时,18岁≤年龄<75岁的门诊患者
4、签署了书面知情同意的患者
5、访视2(第-2周)的血清TG值(空腹时)?22.60mmol/L(2000mg/dL)的受试者
6、※当访视2(第-2周)和访视3(第-1周)的血清TG值(空腹时)的平均值不在≥5.65mmol/L(500mg/dL),?22.60mmol/L(2,000mg/dL)的这一标准之内时,于访视3的1周之后开展访视3.1。
7、访视3的血清TG值(空腹时)?22.60mmol/L(2,000mg/dL)的受试者
8、3※(第-1周)的血清TG值(空腹时)?22.60mmol/L(2,000mg/dL)的受试者
9、访视2(第-2周)与访视3(第-1周)的血清TG值(空腹时)的平均值≥5.65mmol/L(500mg/dL),?22.60mmol/L(2,000mg/dL)的受试者(如果开展访视3.1,则为访视3和访视3.1的血清TG值(空腹时)的平均值≥5.65mmol/L(500mg/dL),?22.60mmol/L(2,000mg/dL)的受试者)
排除标准
1、-6周~-4周※的HbA1c≥8.0%的患者
2、-6周~-4周※的ALT或AST大于正常值上限3倍的患者
3、有心绞痛或心肌梗死既往史或合并症的患者
4、曾接受过经皮腔内冠状动脉成形术、冠状动脉搭桥术的患者
5、已确诊的家族性脂蛋白脂肪酶(LPL)缺乏症、家族性载脂蛋白C-II(ApoC-II)缺乏症、家族III、V型高脂血症患者
6、合并患有甲状腺功能减退、库欣综合征、肢端肥大症、肾病综合征、慢性肾功能衰竭、系统性红斑狼疮、骨髓瘤、NASH的患者
7、药物(肾上腺皮质激素、β-受体阻断剂、口服避孕药、干扰素、维甲酸、利尿药等)引起的高脂血症患者
8、既往或现在有酒精依赖、滥用的患者、或推测高脂血症的主要病因为酒精的患者
9、合并患有主动脉瘤的患者、或在6个月内接受过主动脉瘤切除术的患者
10、血压无法控制的高血压患者(访视1(第-4周)中坐位测定时的收缩压≥180mmHg或舒张压≥110mmHg的患者)
11、存在胰腺炎既往史或合并症的患者、或通过检查等疑似患有胰腺炎的患者
12、经诊断患有胰脏、胆管相关肿瘤性疾病的患者
13、合并患有1型糖尿病或需要胰岛素治疗的2型糖尿病的患者
14、在6个月以内出现与出血有关的以下表现的患者:存在具有临床意义的出血性疾病(脑出血、血友病、毛细血管脆性疾病、消化道溃疡、尿路出血、咯血、玻璃体出血等)既往史或合并症;存在具有临床意义的出血倾向(月经过多、频繁鼻出血等);存在重度外伤既往史或合并症;实施需要输血的手术
15、曾服用过EPA制剂的患者
16、曾使用过PCSK9抑制剂的患者
17、在4周以内曾服用过高脂血症治疗药的患者
18、孕妇、哺乳期妇女、可能已经怀孕的患者
19、存在多价不饱和脂肪酸或明胶过敏史的患者
20、存在恶性肿瘤既往史或合并症的患者
21、合并患有肝脏、肾脏、血液、呼吸系统、消化系统、心血管系统、精神神经系统、代谢/电解质异常或过敏症等严重疾病的患者
22、在3个月以内曾服用其他试验药物的患者
23、其他,研究者判断不适合作为本试验研究对象的患者
24、访视2(第-2周)的收缩压≥180mmHg或舒张压≥110mmHg的受试者
25、自访视1(第-4周)起变更了糖尿病治疗药(除胰岛素外)的用量或变更了治疗药的受试者
26、访视3(第-1周)的收缩压≥180mmHg,或舒张压≥110mmHg的受试者
27、访视2(第-2周)的HbA1c≥8.0%的受试者
28、访视2(第-2周)的ALT或AST超过参考值上限3倍的受试者
29、自访视1(第-4周)起变更了糖尿病治疗药(除胰岛素外)的用量或变更了治疗药的受试者
30、访视3的HbA1c≥8.0%的受试者
31、访视3的ALT或者AST超基准值上限3倍的受试者
32、自访视1变更过糖尿病治疗药(胰岛素除外)的用量,或者变更过治疗药的受试者
33、访视4(第0周)的收缩压≥180mmHg或舒张压≥110mmHg的受试者
34、访视3※(第-1周)的HbA1c≥8.0%的受试者
35、访视3※(第-1周)的ALT或AST超过参考值上限3倍的受试者
36、自访视1(第-4周)起变更了糖尿病治疗药(除胰岛素外)的用量或变更了治疗药的受试者