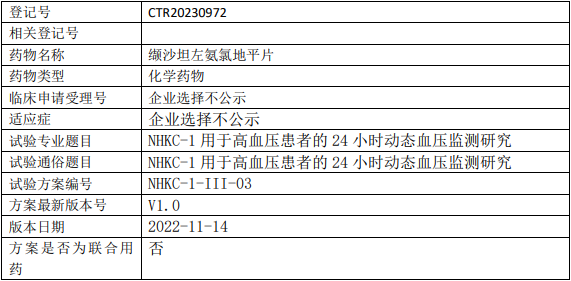
阳光诺和/百奥药业缬沙坦临床试验,NHKC-1(缬沙坦左氨氯地平片)治疗高血压24小时动态血压监测的III期临床试验
试验目的
以24小时动态血压监测(ABPM)评价NHKC-1(80mg/2.5mg)用于治疗原发性轻、中度高血压的有效性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、18周岁≤年龄≤75周岁的成年人(男女兼有)且19.0≤BMI≤30.0kg/m2。
2、根据《中国高血压防治指南》(2018修订版)诊断标准,诊断为轻、中度原发性高血压。
3、筛选时满足以下任一情况的患者进入2周的安慰剂导入期:
●未接受治疗的患者(新近诊断的原发性高血压或虽有高血压病史但在筛选前至少4周未服用任何降压药物),诊室血压符合90mmHg≤sitDBP<110mmHg,且140mmHg≤sitSBP<180mmHg;
●正在接受降压药物治疗,诊室血压为90mmHg≤sitDBP<110mmHg,且140mmHg≤sitSBP<180mmHg。
4、安慰剂导入结束后,诊室血压符合90mmHg≤sitDBP<110mmHg且140mmHg≤sitSBP<180mmHg;及24小时动态血压平均值≥130/82mmHg,进入治疗期。
5、对于具有潜在生育能力的男性或女性受试者在筛选期至服用最后一剂试验药物后至少1个月,必须愿意采取有效的避孕措施(筛选前未服用避孕药受试者,研究期间禁止使用;如筛选前服用避孕药,在研究期间应尽量不改变使用药物及剂量)。
6、受试者能够和研究者保持良好的沟通,充分了解试验的目的、过程以及风险等信息,同意遵守临床试验的各项要求,并自愿签署并同意书。
排除标准
1、特殊人群高血压(难治性高血压受试者、高血压急症和亚急症等)和继发性高血压。
2、既往对苯磺酸氨氯地平、左旋氨氯地平或缬沙坦及相关药物(二氢吡啶类钙通道阻滞剂、血管紧张素II受体阻滞剂)过敏。
3、近5年内具有恶性肿瘤病史(已治愈的皮肤基底细胞癌、宫颈原位癌除外),或目前正在评估潜在的恶性肿瘤。
4、研究者认为不能很好控制的糖尿病患者(空腹血糖>11.1mmol/L或糖化血红蛋白>9%)或有合并症(肾病(eGFR<60mL/min)、周围神经病变者)。(CG-GFR公式:男性Ccr=(140-年龄)×体重(kg)×1.23/血肌酐(umol/L);女性Ccr=(140-年龄)×体重(kg)×1.03/血肌酐(umol/L))。
5、有自身免疫病(需要全身用糖皮质激素治疗)、甲状腺功能异常(甲功五项检查异常且有临床意义)的受试者。
6、筛选前3个月内有下列疾病史或症状者:
●严重阻塞性冠状动脉疾病、快速型心律失常、心力衰竭、二度至三度心脏传导阻滞;
●患有出血性脑卒中或缺血性脑卒中;
●双侧或单侧肾动脉狭窄;
●严重主动脉狭窄;
●胆道梗阻;
●房颤。
7、筛选前3个月内曾接受或正在接受任何其他试验药物或试验器械的治疗。
8、筛选前3个月内有药物滥用史、酗酒史(酗酒史:平均每天饮酒量超过啤酒720mL、酒精量40%的烈酒90mL、葡萄酒300mL)。
9、妊娠或哺乳期的女性。
10、安慰剂导入期用药依从性<80%或>120%。
11、肝/肾功能受损(本地实验室检查):丙氨酸氨基转移酶或天门冬氨酸氨基转移酶>2倍正常值上限;总胆红素>1.5倍正常值上限;血肌酐>1.5倍正常值上限或尿蛋白>++。
12、研究者认为不适合参加本试验的其他情况。