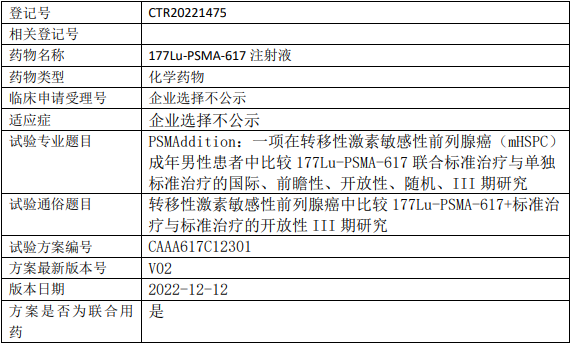
诺华177Lu-PSMA-617临床试验,比较177Lu-PSMA-617联合标准治疗与单独标准治疗在转移性激素敏感性前列腺癌治疗中开放性的III期临床试验
试验目的
本研究的目的是在转移性激素敏感性前列腺癌(mHSPC)成年男性患者中评价177Lu-PSMA-617联合标准治疗与单独标准治疗相比的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:交叉设计
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男
健康受试者:无
出入排标准
入选标准
1、参加研究前必须获取已经签署的知情同意书。
2、患者必须为年龄≥18岁的成年人。
3、患者的ECOG体能状态评分必须为0–2。
4、患者的预期寿命必须>9个月(由研究者判断)。
5、患者必须患有经组织学或细胞学证实的转移性前列腺癌(当前或既往前列腺和/或转移部位活检)。
6、患者必须有68Ga-PSMA-11PET/CT扫描显示PSMA阳性疾病的证据,并由申办者的中心阅片人确定合格性。
7、患者必须在随机化前28天内以以下方式证实至少存在1处骨和/或软组织/内脏部位的转移性病灶:
a.ADT前或基线显示99Tc-MDP骨扫描显像可见骨转移性疾病(任何分布);和/或;
b.任何大小或分布的淋巴结转移。如果淋巴结是唯一的转移部位,则至少一个淋巴结的短径必须至少为1.5cm,且位于骨盆外;和/或;
c.任何大小或分布的内脏转移,如果受试者在随机化前的任何时间有内脏转移史,则应将其编码为在基线时有内脏转移(即,ADT前有内脏转移且在基线时消失的患者将被视为有内脏转移,分层属于高肿瘤负荷)。
8、患者必须有足够的器官功能:
骨髓储备:
●ANC≥1.5×10^9/L;
●血小板≥100×10^9/L;
●血红蛋白≥9g/dL;
肝脏:
●总胆红素≤2倍正常值上限(ULN),对于已知Gilbert综合征≤3×ULN的患者,允许丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)≤3.0×ULN或肝转移患者≤5.0×ULN;
肾脏:
●使用肾脏疾病饮食改良(MDRD)公式计算的eGFR≥50mL/min/1.73m^2。
9、白蛋白≥2.5g/dL。
10、健康且获得性免疫缺陷综合征(AIDS)相关结局风险较低的人类免疫缺陷病毒(HIV)感染患者可参加本试验。
11、患者必须:
●初治或接受最低限度的以下治疗:
●签署ICF前,允许促黄体激素释放激素(LHRH)激动剂/拮抗剂或双侧睾丸切除术联合或不联合第一代抗雄激素药物(如比卡鲁胺、氟他胺)治疗转移性前列腺癌的时间≤45天;
●如果给予,在开始治疗前或给药45天后(以先发生者为准)必须停用第一代抗雄激素药物;
●如果接受LHRH激动剂/拮抗剂联合或不联合第一代抗雄激素药物用于辅助/新辅助治疗,必须在签署ICF前>12个月已停止使用,且治疗不得超过24个月,且在完成辅助/新辅助治疗后12个月内不得显示疾病进展;
●签署ICF前,允许接受≤45天的CYP17抑制剂或ARDT治疗转移性前列腺癌;
●前列腺癌的早期阶段不允许暴露于CYP17抑制剂或ARDT。
排除标准
1、需要紧急暴露于含紫衫类化疗的快速进展的肿瘤患者。
2、任何全身性抗前列腺癌治疗(入选标准11中列出的药物除外),包括化疗、多聚(腺苷二磷酸核糖)聚合酶(PARP)抑制剂、免疫治疗或生物治疗(包括单克隆抗体)。
3、同时进行的细胞毒性化疗、免疫治疗、放射配体疗法、PARP抑制剂、生物疗法或研究治疗。
4、随机化前6个月内接受过以下任何治疗:锶-89、钐-153、铼-186、铼-188、镭-223、半身照射,不允许既往接受过PSMA靶向放射配体疗法。
5、正在参加任何其他临床试验。
6、随机化前30天内使用过其他研究药物。
7、已知对任何研究治疗或其辅料,或对相似化学类别的药物过敏。
8、输血的唯一目的是使受试者有资格入选研究。
9、伴有中枢神经系统不稳定、有症状或者接受糖皮质激素治疗以维持神经系统功能完整性的CNS转移受试者;如果硬膜外疾病、椎管疾病和既往脊髓受累区域已接受治疗、稳定且无神经损害,则有资格参加研究;允许纳入既往接受过治疗且神经系统稳定、无症状且未因CNS转移而接受过类固醇治疗的存在脑实质CNS转移(或CNS转移史)的患者;基线和后续影像学成像必须包括脑部评价(首选磁共振成像(MRI)或增强CT)。
10、诊断为可能会改变预期寿命或可能干扰疾病评估的其他恶性肿瘤;然而,有恶性肿瘤既往史但已充分治疗且无疾病、随机化前未接受治疗超过3年的受试者有资格参加研究或充分治疗的非黑色素瘤皮肤癌、浅表性膀胱癌患者也有资格参加研究。
11、并发严重(由主要研究者确定)医学疾病,包括但不限于难以控制的感染、已知的活动性乙型肝炎或丙型肝炎,或研究者认为可能损害研究参与或合作的其他重大共病;仅在完全恢复(根据当地指南)时,才可纳入在知情同意时存在活动性记录的COVID-19感染(任何疾病严重程度级别)的受试者。
12、存在具有临床意义的活动性心脏疾病,定义为以下任何一项:
●签署ICF前6个月内NYHA3/4级充血性心力衰竭,除非治疗后改善,且超声心动图或MUGA显示EF>45%,症状改善至<3级;
●既往或当前诊断为ECG异常,表明研究受试者存在重大安全性风险,例如:伴随具有临床意义的心律失常,例如持续性室性心动过速、完全性左束支传导阻滞、高度房室传导(AV)阻滞(例如双束支传导阻滞、MobitzII型和三度房室传导阻滞);
●家族性长QT综合征病史或已知的尖端扭转型室性心动过速家族史;
●心脏异常或心脏复极化异常,包括以下任何一项:签署ICF前6个月内有心肌梗死(MI)、心绞痛或冠状动脉旁路移植术(CABG)史。
13、可能干扰研究目的和评估的躯体或精神疾病/病症史。
14、有症状的脊髓压迫,或提示即将发生脊髓压迫的临床或影像学结果。
15、任何妨碍抬起手臂位置的情况。
16、并发难以控制的膀胱流出道梗阻或尿失禁。
17、有性生活的男性在研究治疗期间和停止研究治疗后14周内不愿意在性交时使用避孕套;所有性活跃的男性受试者都需要使用避孕套,以防止其伴侣怀孕,并防止研究药物通过精液输送至伴侣;此外,男性受试者不得在上述规定时间阶段捐献精子;如果当地法规偏离上述预防妊娠的避孕方法,则当地法规适用,并将在ICF中进行描述。