湖北生物医药/人福医药HWH340临床试验,HWH340片治疗胚系或体细胞BRCA1/2突变的转移性去势抵抗性前列腺癌患者的IIa期临床试验
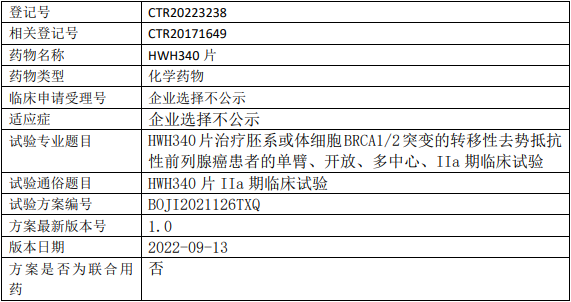
试验目的
主要目的
基于研究者评估的影像学变化(根据RECIST 1.1和PCWG3标准),初步评价HWH340片多次给药在胚系或体细胞BRCA1/2突变的转移性去势抵抗性前列腺癌(mCRPC)患者中的抗肿瘤作用。
次要目的
1、初步评价HWH340片在mCRPC患者中降低血清PSA的作用;
2、初步探索HWH340片对mCRPC患者疼痛和生存质量的影响;
3、初步评价HWH340片在mCRPC患者中的安全性和耐受性。
试验设计
试验分类:安全性和有效
性试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 无上限 (最大年龄)
性别:男
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁,男性;
2、经组织学和/或细胞学确诊为前列腺癌,合并纯小细胞或神经内分泌癌除外;
3、经CSCO前列腺癌诊疗指南2022年版诊断为去势抵抗性前列腺癌,即血清睾酮达到去势水平(<50ng/dL或1.7nmol/L)后,出现下面情况的一种:①血清PSA进展: PSA>1ng/mL且PSA相隔1周连续3次上升,2次大于最低值50%;
4、既往接受至少一种新型激素治疗(醋酸阿比特龙、恩杂鲁胺等)失败(治疗过程中发生疾病进展)或无法耐受;
5、既往接受至少一种针对CRPC的紫杉烷类(如多西他赛、卡巴他塞)化疗失败(治疗过程中或治疗后6个月内发生疾病进展),或临床评估无法耐受,或患者拒绝接受化疗,不包括用于治疗激素敏感型前列腺癌(HSPC)的紫杉烷类化疗;
6、经血液、肿瘤组织或ctDNA检测发现存在胚系或体细胞BRCA1/2突变;
7、入组前7天内,器官功能满足以下实验室检查标准:
●骨髓功能:ANC≥1.5×109/L,PLT≥90×109/L,Hb≥90g/L;
●肝功能:AST/ALT≤2.5×ULN(存在肿瘤肝转移者为≤5×ULN),TBIL≤1.5×ULN;
●肾功能:Scr<1.5×ULN,eGFR≥45mL/min/1.73m2;
8、ECOG评分≤2分;
9、预计生存时间≥12周;
10、有生育能力的受试者同意在研究期间及末次给药后6个月内采取医学认可的有效避孕措施;
11、同意参加本试验并自愿签署知情同意书。
排除标准
1、已知对试验药物或同类药物过敏;
2、既往接受过任何PARP抑制剂治疗;
3、既往接受过任何DNA损伤类细胞毒性化疗(如米托蒽醌、环磷酰胺、铂类等),非前列腺癌且最后一次细胞毒性化疗距离入组前超过5年的除外;
4、筛选前3年内患有其它恶性肿瘤(包括骨髓增生异常综合征和单克隆丙球蛋白血症),已经治愈的非黑色素瘤皮肤癌、原位或浅表性膀胱癌除外;
5、伴有严重心脑血管疾病,如纽约心脏病协会NYHA心功能分级为III-IV级的充血性心力衰竭、未控制的高血压(收缩压≥160mmHg或舒张压≥100mmHg)、筛选前3个月内发生心肌梗死、急性脑卒中、控制不良的心律失常或不稳定性心绞痛;
6、入组前4周(或对应药物5个半衰期,以较短者为准)内进行过系统化疗、新型激素治疗、靶向治疗、免疫治疗、抗肿瘤中草药或其它抗肿瘤治疗(包括5-α还原酶抑制剂、雌激素和甲地孕酮等),维持去势治疗(LHRH激动剂或拮抗剂)或骨转移治疗(如地诺单抗、唑来膦酸)除外;
7、入组前4周内进行过大型手术、全身放疗或生物治疗,或入组前1周内进行过小型手术或局部放化疗;
8、入组前2周内使用过CYP3A4或CYP2D6抑制剂;
9、存在既往抗肿瘤治疗导致的>2级毒性(CTCAE5.0标准),脱发、研究者认为无安全性风险的实验室检查异常或LHRH激动剂或拮抗剂相关的毒性除外;
10、存在有症状(如头晕、头痛、恶心、呕吐等)的脑转移或脊髓压迫;
11、研究者认为可能影响研究药物给药或方案依从性的基础医学疾病(如酒精或药物滥用、精神疾病等);
12、无法吞咽口服药物或可能干扰药物吸收的胃肠道疾病者;
13、伴有急性炎症或有临床意义的活动性感染者;
14、血清HCV抗体、梅毒螺旋体抗体或HIV抗体检测阳性,或HBsAg阳性合并HBV-DNA>1000IU/mL者;
15、筛选前3个月内参加过其它临床试验者;
16、研究者认为的任何其它情况不适合参加本临床试验者。