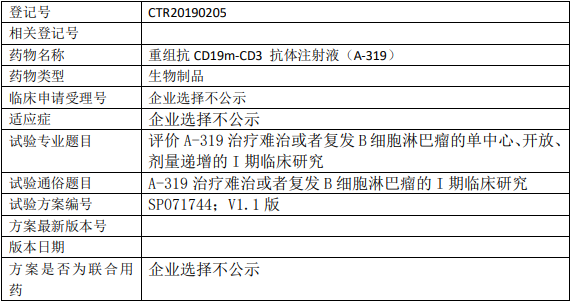
健能隆医药A-319临床试验,评价重组抗CD19m-CD3抗体注射液(A-319)治疗难治或者复发B细胞淋巴瘤的单中心、开放、剂量递增的I期临床试验
试验目的
本实验主要目的是评价A-319治疗难治或者复发B细胞淋巴瘤的安全性和耐受性,确定难治或者复发B细胞淋巴瘤对A-319的最大耐受剂量(MTD)及剂量限制性毒性(DLT)。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、愿意签署知情同意书并且能够遵从方案的要求;如果患者不能签署知情同意书,需其法定监护人或者代理人签署
2、18-75岁;性别不限
3、患有组织学或细胞学确诊的B细胞淋巴瘤,包括【滤泡性淋巴瘤(FL),边缘区淋巴瘤(MZL)、套细胞淋巴瘤(MCL)、弥漫大B细胞淋巴瘤(DLBCL)】
4、接受过含利妥昔单抗方案一线(联合化疗或单药)充分治疗【充分治疗定义为按病理类型和疾病分期要求完成利妥昔单抗联合化疗足周期治疗,或利妥昔单抗单药治疗375mg/m^2每周一次注射至少四次诱导治疗未能达到CR缓解(CR或PR)】或治疗期间/充分治疗结束6个月后进展;接受过充分一线诱导或者挽救治疗(至少有一种方案含利妥昔单抗,除非利妥昔单抗不耐受)后达到缓解(CR或PR)后再次出现疾病进展,包括第2次或2次以上的复发、或者造血干细胞移植(HSCT)后复发
5、东部肿瘤协作组(ECOG)身体状况评分≤2分
6、在治疗前21天内,具有可测量病灶(对于FL、MCL、MZL、SLL、DLBCL,要求淋巴结病灶任一长径>1.5cm或结外病灶要求任一长径>1.0cm)
7、骨髓功能基本正常(筛选前14天内未输血、使用G-CSF、未使用药物纠正),包括:ANC≥1.5x10^9/L;血小板≥75x10^9/L;Hgb≥9.0g/dL
8、肝、肾、肺、心脏功能基本正常:
(1)肝功能:血清总胆红素≤1.5×ULN(除非有证据表明受试者患有Gilbert综合征,则≤3.0×ULN);谷草转氨酶(AST)和谷丙转氨酶(ALT)≤2.5×ULN;(≤5.0×ULN,如果有肿瘤继发性的改变影响到肝脏);
(2)血清肌酐≤1.5×正常参考值上限(ULN)或估计肌酐清除率≥50mL/min(按实地测量中心的计算标准);
(3)超声心动检查:LVEF50%,无心包积液;12导联心电图结果:无临床显著的心电图异常(任何级别的房颤、II度II型房室传导阻滞或III度房室传导阻滞或QTcF>470msec(女性)或>450msec(男性);其他未得到控制的症状性心律失常);
(4)无显著临床意义的胸腔积液;
(5)血氧饱和度>92%(非吸氧状态下)。
9、预期寿命至少3个月
排除标准
1、既往或伴有中枢神经系统疾病包括:癫痫、出血性/缺血性脑卒中、严重脑损伤、痴呆、帕金森病、小脑疾病、器质性脑综合征、精神疾病等
2、伴有淋巴瘤中枢神经系统浸润
3、既往自身免疫病史且伴中枢神经系统受累或伴有自身免疫病
4、既往或伴有其他恶性肿瘤(已治愈的皮肤基底细胞或者鳞状细胞癌、宫颈原位癌、前列腺上皮内瘤除外)
5、有深静脉血栓或肺栓塞病史
6、研究药物治疗开始前12周内接受自体造血干细胞移植术(Auto-HSCT)
7、既往接受器官移植或异体造血干细胞移植术(Allo-HSCT)
8、研究者判断患者伴有可能影响研究结果或者依从性的疾病、医疗状况或者社会因素,方案规定下列状况不能参加本研究:
(1)不能控制或需要静脉输注抗生素治疗的急性感染(积极治疗能有效控制的非复杂性急性尿路感染或急性细菌性咽侯炎除外)或者确诊为菌血症;
(2)已知人类免疫缺陷病毒(HIV)感染;
(3)乙肝表面抗原(HBeAg)阳性或丙型肝炎感染(HCV抗体阳性);
(4)纽约心脏协会[NYHA]心功能不全分级为3级或者4级;
(5)既往发生急性心肌梗死、不稳定型心绞痛;
(6)未能控制的高血压,收缩压>180mmHg和舒张压>100mmHg
9、正在使用免疫抑制剂,包括但不限于:A-319治疗前14天内使用环孢霉素、他克莫司等;A-319治疗前14天内接受高剂量的糖皮质激素(每天剂量>10mg的强的松或者相当剂量的其它糖皮质激素,以及吸入用糖皮质激素)
10、A-319治疗前6周内接受过放疗
11、A-319治疗前4周内接受过化疗、免疫治疗、靶向治疗
12、既往接受过CAR-T等细胞治疗
13、A-319治疗前4周内接受过抗淋巴瘤的研究药物
14、末次治疗的毒性效应中未恢复(CTCAE级的不良事件),脱发除外;
15、入组前28天行大型手术者(不包括淋巴结活检手术);或拟在研究期间进行手术者
16、筛选前28天内曾接种过活性/减毒性活疫苗者
17、怀孕(妊娠试验阳性)、哺乳期的妇女,签署知情同意书至研究结束至少3个月内不同意使用避孕措施的育龄期妇女;治疗第1天前7天内,育龄妇女需血清妊娠试验(HCG)检测阳性
18、签署知情同意书至研究结束至少3个月内不同意使用避孕措施的男性患者(手术绝育除外)
19、已知对免疫球蛋白或研究药物及其赋形剂过敏
20、研究者认为不适宜参加本项研究的患者