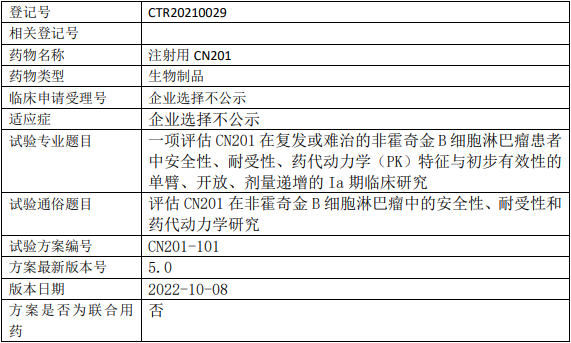
同润生物CN201临床试验,评估注射用CN201治疗复发或难治的非霍奇金B细胞淋巴瘤安全性、耐受性、药代动力学(PK)特征与初步有效性的Ia期临床试验
试验目的
1.确定在复发或难治的B-NHL患者中给予CN201的安全性和耐受性、剂量限制性毒性(DLT)、最大耐受剂量(MTD)和/或II期推荐剂量(RP2D);
2.初步观察CN201在复发或难治的B-NHL患者中的抗肿瘤疗效;
3.评估CN201在复发或难治的B-NHL患者中的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁,≤75周岁,性别不限;
2、复发或难治的B-NHL患者。须符合病理免疫组化CD19阳性的下述世界卫生组织(WHO)的B-NHL诊断亚型:弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)(I~III级)、边缘区淋巴瘤、淋巴浆细胞淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、转化型大B细胞淋巴瘤;
3、根据Lugano2014标准,至少有一个可评估的肿瘤病灶,即根据计算机断层扫描(CT)横断面影像淋巴结病灶长径>15mm,或结节外病灶长径>10mm;
4、美国东部肿瘤协作组(ECOG)体力评分≤2分,并且预计生存时间3个月以上的患者;
5、骨髓功能基本正常的患者,包括:PLT≥75×10^9/L,中性粒细胞绝对计数(ANC)≥1.5×10^9/L,外周血淋巴细胞绝对计数(ALC)≥200/μL,血红蛋白(Hgb)≥9.0g/dL;
6、凝血功能基本正常的患者:活化部分凝血活酶时间(APTT)≤1.5×正常值上限(ULN);国际标准化比值(INR)≤1.5×ULN;
7、肝、肾、肺、心脏功能基本正常的患者:
(a)肝功能:血清总胆红素≤1.5×ULN(除非有证据表明患者患有Gilbert综合征,则≤3.0×ULN);谷草转氨酶(AST)和谷丙转氨酶(ALT)≤2.5×ULN;(如果有肿瘤继发性改变影响到肝脏,则≤5.0×ULN);
(b)血清肌酐≤1.5×ULN或估计肌酐清除率≥50mL/min(按实际测量中心的计算标准);
(c)超声心动检查:左室射血分数(LVEF)≥50%,无心包积液;12导联心电图(ECG)结果:无临床显著的ECG异常[任何级别的房颤、II度II型房室传导阻滞或III度房室传导阻滞或QTcF>470msec(女性)或>450msec(男性);其他未得到控制的症状性心律失常];
(d)无显著临床意义的胸腔积液;
(e)血氧饱和度>92%(非吸氧状态下)。
8、患者须在试验前对本研究知情同意,并自愿签署书面的ICF。
9、育龄期女性患者在首次使用试验用药品前7天内的血或尿妊娠试验必须为阴性;有生育能力的患者(男性和女性)必须同意自签署ICF至末次用药后90天内与其伴侣一起使用可靠的避孕方法(激素或屏障法或禁欲)。
排除标准
1、在首次使用试验用药品前4周内接受过化疗、小分子靶向药物、内分泌治疗、或其他抗肿瘤药物治疗的患者;
2、在首次使用试验用药品前4周内,或药物的5个半衰期内(以时间长的为准)接受过抗肿瘤免疫治疗或其他未上市的临床试验用药品的患者(本研究2.5μg/次、5μg/次剂量组的受试者在停止本试验用药治疗后,经研究者判定受试者可能在高剂量组有受益,遵从患者意愿,经申办者同意,经药物的5个半衰期洗脱后,允许一次机会参加较高剂量组用药)。
3、在首次使用试验用药品前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术的患者;
4、在首次使用试验用药品前4周内使用过减毒活疫苗的患者;
5、伴有中枢神经系统(CNS)浸润的患者;
6、既往或伴有CNS疾病的患者,包括:癫痫、出血性/缺血性脑卒中、严重脑损伤、痴呆、帕金森病、小脑疾病、器质性脑综合征、精神疾病等;
7、既往或伴有其他恶性肿瘤(已治愈的皮肤基底细胞或者鳞状细胞癌、宫颈原位癌、前列腺上皮内瘤除外)的患者;
8、有活动性感染,且目前需要系统性抗感染治疗的患者;
9、有活动性乙型肝炎和/或丙型肝炎的患者;
10、有免疫缺陷病史的患者;
11、目前或曾患有间质性肺病的患者;
12、曾接受免疫治疗并出现≥3级免疫相关不良事件的患者;
13、研究者认为患者存在其他原因而不适合参加本临床研究。