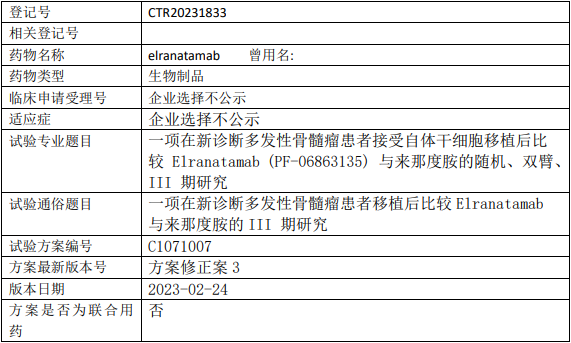
辉瑞Elranatamab临床试验,新诊断多发性骨髓瘤患者接受自体干细胞移植后比较Elranatamab(PF-06863135)与来那度胺疗效的III期临床试验
试验目的
主要目的
比较Elranatamab与来那度胺的疗效。
关键次要目的
比较Elranatamab与来那度胺的疗效
次要目的
1、比较Elranatamab与来那度胺的疗效;
2、确定Elranatamab的安全性和耐受性;
3、评价Elranatamab的药代动力学;
4、评价Elranatamab的免疫原性;
5、评价研究治疗干预对受试者HRQoL的影响。
三级/探索性目的
1、探索Elranatamab和受试者MM生物学之间的关系;
2、在数据允许的情况下,探索Elranatamab暴露量与疗效、安全性和生物标志物终点之间的关联;
3、评价研究治疗干预对患者报告症状和功能的影响;
4、收集医疗资源利用数据。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者在筛选访视或预筛选访视(如适用)时的年龄≥18岁。男性受试者和有生育潜能的女性受试者必须同意使用方案附录4中所述的避孕方法。
2、受试者愿意并且能够遵从所有计划访视、治疗计划、实验室检查、生活方式注意事项和其他研究程序。
3、根据IMWG标准被确诊为MM且确诊时疾病可测量,定义为血清M蛋白≥0.5g/dL(5g/L)、尿液M蛋白≥200mg/24小时或血清FLC测定中受累的FLC水平≥10mg/dL并伴有血清FLC比值异常。-曾在NDMM诱导治疗持续3至8个周期后接受高剂量治疗和ASCT。随机化必须在干细胞移植后120天内进行。对于在ASCT后接受巩固治疗的受试者,随机化必须在巩固治疗后60天内和ASCT后7个月内进行。
4、随机化时根据IMWG标准确定为PR或更佳。
5、通过中心实验室NGS检测评估确定了优势恶性(指示)克隆。-必须有一份确定优势恶性(指示)克隆的存档骨髓穿刺样本,用于通过中心实验室评估追踪MRD状态。该样本最好在诱导治疗前(例如诊断时)或移植前采集。移植后采集的样本经申办方批准后可予以接受。
6、ECOG体力状态≤1。
7、通过MUGA扫描或ECHO测定的LVEF≥40%。
8、足够的肝功能,定义如下:
-总胆红素≤2×ULN(如果有Gilbert综合征,直接胆红素>ULN则排除);
-AST≤2.5×ULN;且-ALT≤2.5×ULN。
9、根据当地机构标准方法确定具有足够的肾功能:eGFR≥30mL/min/1.73m2(根据2021CKD-EPI方程[https://www.kidney.org/content/ckd-epi-creatinine-equation-2021])或估计CrCL≥30mL/min(根据CockcroftGault公式)。如果使用了两个公式计算,则采用2个结果值中较高的一个。在疑似淀粉样变性的不明确病例中,也可采集24小时尿液检测CrCL
10、筛选和随机化时BM功能在ASCT后充分恢复,定义如下:
-ANC≥1.0×109/L(如在计划给药开始前≥7天完成,则允许使用G-CSF,不得使用G-CSF来达到该水平);
-血小板≥75×109/L(如在计划给药开始前≥7天完成,则允许输血支持);且
-血红蛋白≥8g/dL(如在计划给药开始前≥14天完成,则允许输血支持)。
11、校正的血清钙≤14mg/dL(≤3.5mmol/L)。
12、任何既往治疗带来的急性影响均已恢复至基线严重程度水平或CTCAE等级≤1。
13、能够签署知情同意书,包括遵循知情同意书(ICD)和本方案的要求和限制条件。
排除标准
1、浆细胞白血病,定义为外周血中循环浆细胞超过20%且浆细胞绝对计数>2×109/L。
2、淀粉样变性、华氏巨球蛋白血症或POEMS综合征。
3、已知的活动性CNS受累或出现骨髓瘤性脑膜受累的临床体征。
4、心血管功能受损或有临床意义的心血管疾病,定义为受试者入组前6个月内发生过以下任一疾病:
-急性心肌梗死或急性冠状动脉综合征(例如,不稳定型心绞痛、冠状动脉搭桥术、冠状动脉血管成形术或支架术、有症状的心包积液);
-有临床意义的心律失常(例如未受控制的房颤或未受控制的阵发性室上性心动过速);
-血栓栓塞或脑血管事件(如短暂性脑缺血发作、脑血管意外、深静脉血栓[除非伴有中心静脉通路并发症]或肺栓塞);
-QT间期延长综合征或筛选时QTcF>470msec。
5、仍持续存在的≥3级周围感觉或运动神经病变。
6、GBS或GBS变异病史,或任何≥3级周围运动多发性神经病病史。
7、首次给药前4周内接种过减毒活疫苗。
8、已知或疑似对研究治疗干预或其任何辅料有超敏反应。
9、入组前3年内患有任何其他活动性恶性肿瘤,经充分治疗的基底细胞或鳞状细胞皮肤癌、原位癌或研究者认为复发风险极小的0/1期恶性肿瘤除外。
10、其他手术(包括入组前14天内大手术)、医学或精神状况,包括近期(过去一年内)或主动自杀意念/行为,或实验室检查异常,可能增加参与研究的风险,或根据研究者判断,受试者不适合参加研究。
11、既往接受过MM维持治疗。
12、既往接受过BCMA靶向治疗。
13、在本研究所用的研究治疗干预首次给药前30天(或根据当地要求确定)或5个半衰期内(以时间较长者为准)接受过研究性药物给药或疫苗接种。
14、在研究期间任何时间点妊娠试验阳性(针对有生育潜能的女性)。
15、受试者有活动性、未受控制的细菌、真菌或病毒感染,包括(但不限于)HBV、HCV以及已知HIV或AIDS相关疾病。有关特定情况的备注见下文。
a.COVID-19/SARS-CoV-2:如上文所述,本方案排除了活动性感染患者。虽然本方案不强制要求进行SARS-CoV-2检测,但检测应遵循当地临床实践标准。如果患者入组前14天内的SARS-CoV-2感染检测结果为阳性、已知存在无症状感染或疑似感染SARS-CoV-2,则需要排除。
b.HIV:在不明确的情况下,病毒载量为阴性的受试者可能符合资格。HIV血清阳性的受试者,如果在其他方面健康,并且出现与AIDS相关结局的风险很低,则可以考虑其符合资格。在筛选之前,应根据当前和既往的CD4和T细胞计数、AIDS的病史定义的情况(如机会性感染,如适用)和HIV治疗状态,评估特定的HIV阳性候选者的潜在资格,并与申办方进行讨论。此外,还将考虑药物间相互作用的可能性。
c.HBV/HCV:应在筛选时进行相关实验室检查。更多详情见CDC网站(https://www.cdc.gov/hepatitis/index.htm)。
d.HBV:-该标准排除了HBsAg阳性(即急性或慢性活动性肝炎)受试者。-然而,无论是由于接种疫苗还是之前的自然感染,HBV抗体为阳性表明具有免疫力的受试者均符合资格。-如果未检测到HBVDNA,则抗HBcAb为阳性但HBsAg和抗HBsAb为阴性的患者可参与研究。
e.HCV:-HCV抗体为阳性是感染的标志,但这不一定表示潜在候选人不符合资格,具体取决于临床情况。应与申办方进行讨论。如果最近才暴露于HCV,则HCV抗体可能还未转为阳性。在这种情况下,建议检测HCVRNA。更多详情见CDC网站(https://www.cdc.gov/hepatitis/hcv/pdfs/hcv_graph.pdf)。
16、直接参与研究执行的研究中心工作人员及其家人,以其他方式受研究者监管的研究中心工作人员以及直接参与研究开展的申办方和申办方代表员工及其家人。