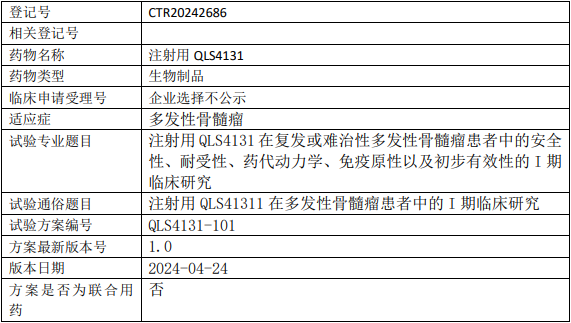
齐鲁制药QLS4131临床试验,注射用QLS4131治疗复发或难治性多发性骨髓瘤安全性、耐受性、药代动力学、免疫原性以及初步有效性的I期临床试验
试验目的
Ia期主要目的
确定QLS4131单药静脉注射和皮下注射给药在复发或难治性多发性骨髓瘤患者中的安全性、耐受性和2期试验推荐剂量(RP2D)。
Ib期主要目的
评估QLS4131单药在复发或难治性多发性骨髓瘤患者中的初步疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿参加并签署书面知情同意书。
2、年龄≥18周岁,性别不限。
3、确诊的多发性骨髓瘤患者。
4、复发或难治多发性骨髓瘤患者在接受可用的既定疗法时发生进展或无法耐受。
5、多发性骨髓瘤患者筛选时存在可测量病灶。
6、血液学满足条件。
7、生化实验室检查值满足条件。
8、美国东部肿瘤协作组体力状况(ECOG PS)评分0~1分。
9、预计生存期≥3个月。
10、有生育能力的患者(男性和女性)必须同意在试验期间和末次用药后至少100天内与其伴侣一起使用可靠的避孕方法(激素或屏障法或禁欲);育龄期的女性患者在首次给药前14天内的血妊娠试验必须为阴性。
11、愿意并能够遵循本方案规定的禁忌和限制事项。
排除标准
1、既往发生过与任何T细胞重定向治疗相关的3级及以上细胞因子释放综合征。
2、在试验药物首次给药前4周内接种减毒活疫苗,或预期在研究期间需要接种减毒活疫苗。
3、除了脱发或周围神经病变外,既往抗肿瘤治疗的毒性均应恢复至基线水平或≤1级。
4、在试验药物首次给药前14天内接受皮质类固醇激素的累计等效剂量相当于≥140mg泼尼松(不包括治疗前用药)。
5、中枢神经系统(CNS)受累,或多发性骨髓瘤累及脑膜的临床症状和体征。
6、确诊华氏巨球蛋白血症、POEMS综合征。
7、签署知情同意前5年内有其他恶性肿瘤史的患者。
8、已知对QLS4131或其辅料有过敏反应、超敏反应或不耐受。
9、需要持续吸氧才能维持足够血氧饱和度水平的肺损害。
10、心脏疾病。
11、任何严重的基础疾病。
12、怀孕、处于哺乳期、或在参加本研究期间或研究治疗末次用药后100天内计划怀孕。
13、入组本研究时或试验药物末次用药后100天内有生育计划的男性患者。
14、在首次给药前的2周内曾经做过重大外科手术,或尚未从手术中完全恢复。
15、首次使用试验药物前6个月内发生过动静脉血栓栓塞事件。