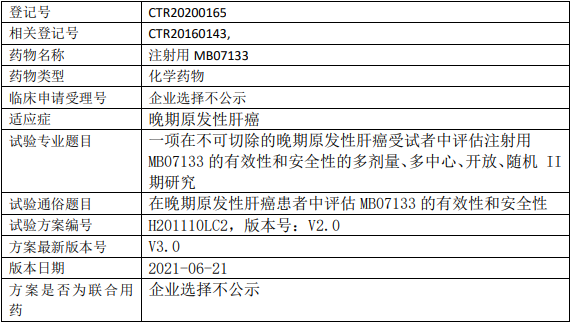
新通药物MB07133临床试验,评估注射用MB07133治疗不可切除的晚期原发性肝癌有效性和安全性的II期临床试验
试验目的
1、评价MB07133单药或联合其他药物治疗不可切除晚期原发性肝癌的疗效;
2、评价MB07133单药或联合其他药物治疗不可切除晚期原发性肝癌的耐受性和安全性;
3、探索注射用MB07133最佳有效剂量,为Ⅲ期用药提供依据。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄为18~75周岁(含18周岁和75周岁),性别不限。
2、经病理诊断(病理组织/细胞学)或临床诊断(动态增强MRI/动态增强CT扫描)确诊的晚期不可切除肝细胞癌/胆管细胞癌/混合性肝癌(不可手术或转移性),经一线治疗失败后或缺乏/不具备一线标准治疗条件的患者。
3、至少有一个可测量病灶(符合RECISIT1.1版标准)。
4、Child-Pugh肝功能评分:A/B(≤7分)。
5、预期生存时间≥12周。
6、ECOG评分0或1分。
7、7.既往肿瘤治疗化/放疗结束4周以上(应用亚硝基脲类和丝裂霉素化疗者停药6周以上,应用小分子靶向药者(索拉非尼、乐伐替尼)停药2周以上),或大于5个半衰期(时间限定以较长者为准);手术治疗>4周,末次介入、放疗和消融治疗结束时间>4周。
8、首次用药前2周内未使用任何抗肿瘤药物(包括但不限于以下具有肝癌适应症的现代中药制剂:得力生注射液、康莱特注射液或软胶囊、艾迪或康赛迪注射液、榄香烯,槐耳颗粒和肝复乐片等)。
9、活动性乙肝病人应得到相应控制,并继续服用抗病毒药物和监测肝功能和乙肝病毒载量(如:HBVDNA<104copies/ml(2000IU/ml))。
10、主要器官功能正常,即符合下列标准:
A.血常规检查:HB≥90g/L;ANC≥1.5×109/L;PLT≥80×109/L;
B.生化检查:ALB≥28g/L;ALT和AST≤5.0×ULN;TBIL≤1.5×ULN;肌酐≤1.5×ULN;电解质正常或经治疗后正常或经研究者判断为异常无临床意义;
C.尿常规检查:尿蛋白≤1+,如尿蛋白2+但24h尿蛋白<1.0g可以入组;
D.心电图结果:男性QTcB<470ms,女性QTcB<480ms。
11、同意在试验期间使用有效的非药物避孕措施者。
12、患者自愿签署书面知情同意书。
排除标准
1、具有临床症状的中等量及以上胸/腹水;既往1个月内接受过胸/腹水引流者;无症状仅影像学发现的少量胸/腹水可以入组。
2、既往有肝移植病史。
3、阻塞性黄疸以及肝功能衰竭,出现肝性脑病;肿瘤侵犯下腔静脉,并形成下腔静脉癌栓者;如可提供组织学/病理学结果,纤维板层型或肉瘤样者不可入组。
4、5年内患有其他原发恶性肿瘤者,但是已接受充分治疗的非黑色素瘤皮肤癌及子宫颈原位癌除外。
5、有活动性出血或凝血功能异常(PT>16s、APTT>43s、INR≥2)、具有出血倾向或正在接受溶栓、抗凝或抗血小板治疗者(因PICC或深静脉置管需要使用肝素除外);28天内有大量出血/失血(大于450ml)者。
6、同时服用可能延长QTc和/或诱发尖端扭转型室速(Tdp)的药物(如胺碘酮、奎尼丁等)。
7、怀孕或者哺乳期妇女。
8、任何显著的临床和实验室异常,研究者认为影响安全性评价者,如:严重或医学上有重要意义的感染、未控制的糖尿病(糖化血红蛋白>7.5%)、患有高血压且经两种或两种以下降压药治疗无法下降到以下范围内者(收缩压<160mmHg,舒张压<100mmHg)、II级或以上周围神经病变(CTCAEV5.0)、充血性心力衰竭、6个月内的心肌梗塞等。
9、脑转移、脑膜转移病情不稳定及精神障碍者;脑转移经治疗后病情稳定(至少4周内无需处理)者可以入组。
10、既往3月之内有消化道出血病史或具有明确的胃肠道出血倾向,如:已知有局部活动性溃疡病灶、大便潜血阳性经3日后复测仍持续阳性者。
11、肾小球滤过率明显异常者(肌酐清除率≤60ml/mim,根据CKD-EPI公式计算)。
12、活动性丙肝,即抗HCV阳性且HCVRNA阳性者,经治疗后HCVRNA转阴者可以入组。
13、HIV抗体阳性者;梅毒螺旋体抗体阳性。
14、在使用研究药物前28天,使用任何已知可抑制或诱导CYP3A4肝微粒体酶的药物或物质者(详细见禁用药物部分)。
15、疑似对araC或同类药物有过敏史的受试者。
16、有痛风症状且血尿酸>430umol/L。
17、任何已知的谷胱甘肽代谢缺陷,或需要大剂量的对乙酰氨基酚/Tylenol?(>1g/天),抑或需要或使用的药物剂量将消耗谷胱甘肽的受试者。
18、无法进行增强核磁检查的患者,如对核磁造影剂过敏者、体内有心脏起搏器、动脉瘤手术、体内有钢钉、钢板等金属物者;女性有节育环者需视情况而定。
19、在使用研究用药前1个月内参加过其它药物临床试验的患者。
20、研究者认为具有其他不适宜参加本研究因素的受试者。