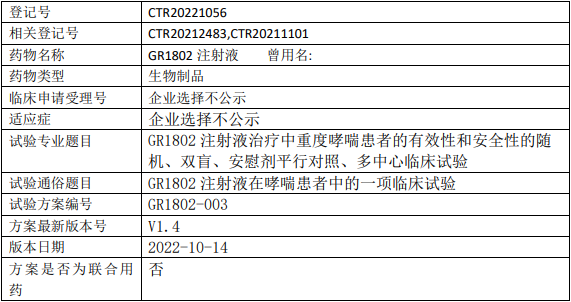
智翔医药/智翔金泰GR1802临床试验,GR1802注射液治疗中重度哮喘患者有效性和安全性的随机、双盲、安慰剂平行对照、多中心的II期临床试验
试验目的
1、评价GR1802注射液在中重度哮喘患者中皮下多次给药的初步疗效;
2、评价GR1802注射液在中重度哮喘患者中皮下多次给药的安全性特征、药代动力学特征、免疫原性;
3、探索GR1802注射液在中重度哮喘患者中皮下多次给药前后生物标记物间水平的变化。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18-70(含临界值)周岁;
2、符合2021版全球哮喘防治创议(GINA)指南要求诊断为哮喘至少12个月;
3、筛选访视和基线访视随机前,支气管扩张剂使用前的1秒钟用力呼气容积(FEV1)测定值≤正常预计值的80%,且≥正常预计值的35%;
4、筛选访视和基线访视随机前,哮喘控制问卷5项问题版本(ACQ-5)评分均≥1.5分;
5、随机前,支气管舒张试验阳性:沙丁胺醇/左沙丁胺醇200-400μg(即2-4喷;如沙丁胺醇/左沙丁胺醇雾化溶液被认为是常规临床操作也适用)给药后15-30分钟FEV1可逆转>12%和200mL;可接受随机前12个月内至少一次支气管舒张试验阳性结果。
6、筛选访视前一年内,必须经历过重度哮喘发作事件;
7、愿意遵循研究方案的要求,患者或其法定代理人愿意签署书面知情同意书。
排除标准
1、患有慢性阻塞性肺病(COPD)或其他可能损伤肺功能的肺病(如特发性肺纤维化、变应性支气管肺曲菌病等,以研究者判断为准);
2、在基线访视前1个月内,经历过一次重度哮喘发作事件的患者;
3、基线访视前12个月内经临床或影像学证据[如胸部X射线、计算机断层扫描(CT)、核磁共振成像(MRI)]确诊哮喘以外的有显著临床意义影响疗效或安全性评价的肺部疾病;
4、筛选时有活动性结核感染的证据;
5、当前吸烟患者或基线访视前6个月内戒烟;
6、既往吸烟患者,吸烟史>10包年;
7、基线访视前2年内,有酗酒(酗酒定义为:每周饮用超过28单位的酒精(1单位=285ml啤酒或25ml酒精含量≥40%的烈酒或1玻璃杯葡萄酒)和/或药物滥用史;
8、长期日常睡眠模式颠倒(如:长期夜班工作者);
9、因任何原因需要接受非选择性β1肾上腺素能受体阻滞剂治疗者,或使用选择性β1受体阻滞剂但在基线访视前1个月内剂量不稳定;
10、基线访视前130天内接受过IgE抗体治疗、或既往接受过IL-4R抗体(如:dupilumab)治疗者;5个半衰期(半衰期已知)或6个月(半衰期不详)内接受过其它生物制剂;
11、基线访视前4周内接受具有平喘作用的中草药、中成药治疗(局部中草药除外);
12、基线访视前3个月内接受过或计划试验期间接受免疫球蛋白(IVIG)治疗、变应原特异性免疫治疗(SIT);
13、基线访视前3年内接受过支气管热成形术治疗,或计划在试验期间采用该疗法治疗;
14、合并其他疾病需要使用ICS(如:肺结核)或LABA(例如:严重心脏病、胰岛素依赖的糖尿病、无法控制的高血压、甲亢等)导致合并疾病治疗受影响;
15、需要药物治疗的QTc间期延长或室性心动过速;
16、妊娠、哺乳期妇女;
17、筛选时乙型肝炎表面抗原阳性(HBVDNA检测低于500IU/ml除外)、乙肝核心抗体阳性(HBVDNA检测低于500IU/ml除外);丙型肝炎病毒抗体阳性、人类免疫缺陷病毒(HIV)抗体阳性、抗梅毒螺旋抗体(TP-Ab)阳性(RPR或TRUST阴性者除外);
18、基线访视前4周内存在或疑似急性或慢性感染者,并接受过抗菌、抗病毒、抗真菌、抗寄生虫或抗原虫治疗者;
19、基线访视前12周内接受过活/减毒疫苗接种或计划在试验期间接受活/减毒疫苗接种者;
20、有重要器官移植(如:心、肺、肾、肝)或造血干细胞/骨髓移植史;
21、活动的自身免疫病患者,或正在使用免疫抑制剂治疗的自身免疫病患者(如:炎症性肠病、原发性胆汁性肝硬化、系统性红斑狼疮、多发性硬化症、银屑病、桥本甲状腺炎、格雷夫斯病);
22、基线访视前5年内患有恶性肿瘤(经过彻底治疗且没有任何复发迹象的皮肤原位鳞癌、基底细胞癌和原位宫颈癌除外);
23、控制不佳的高血压(收缩压≥160mmHg和/或舒张压≥100mmHg。注释:由2次连续升高读数确定。如果初始血压读数超过此限值,则可在受试者休息≥10分钟后重新测量血压。如果重复测量值低于限值,则可以接受第二个值);
24、筛选时存在以下实验室检测异常:
●血红蛋白(男性)<10.0g/dL(100.0g/L),或(女性)<9.0g/dL(90.0g/L);
●白细胞计数<3.0×109/L;
●中性粒细胞计数<1.5×109/L;
●血小板计数<100×109/L;
●丙氨酸氨基转氨酶(ALT)和/或天冬氨酸氨基转氨酶(AST)>1.5倍正常值上限(ULN);
●血清肌酐>1.0倍ULN;
●总胆红素>1.5倍ULN;
●碱性磷酸酶>1.5倍ULN;
25、具有生育能力的女性和/或男性及其伴侣拒绝自签署知情同意书后至末次给药结束后6个月内:采取高效(女性受试者及其伴侣)/有效(男性受试者及其伴侣)的避孕措施者、有生育、捐献卵子计划(女性)或捐献精子计划(男性);
26、基线访视前12周内参加过其它临床试验治疗;
27、研究者认为不合适参加本研究的其他原因;
28、有严重的疱疹病毒感染史,如:疱疹脑炎、播散性疱疹等。