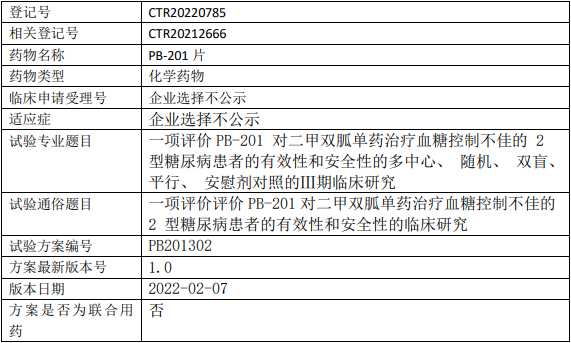
派格生物PB-201临床试验,评价PB-201片对二甲双胍单药治疗血糖控制不佳的2型糖尿病的Ⅲ期临床试验
试验目的
主要目的
通过糖化血红蛋白(HbA1c)自基线到治疗24周后变化,评价在联合盐酸二甲双胍的条件下,PB-201与安慰剂相比对二甲双胍单药治疗血糖控制不佳的2型糖尿病患者的有效性。
次要目的
在联合盐酸二甲双胍条件下,评价PB-201的安全性和治疗52周后的有效性。
完善PB-201及其代谢产物的群体药代动力学模型,系统性定量研究人口学特征、糖尿病病程、合并用药等指标对药代动力学(PK)特征的影响。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、筛选时年龄≥18周岁,≤75周岁的男性或女性;
2、确诊的T2DM患者,符合WHO1999年颁布的2型糖尿病诊断标准
3、筛选前在饮食和运动干预的基础上接受稳定剂量的盐酸二甲双胍单药治疗≥8周且盐酸二甲双胍剂量≥1500mg/天或为最大耐受剂量(<1500mg/天但≥1000mg/天)
4、糖化血红蛋白(HbA1c)必须满足以下标准:筛选时HbA1c≥7.5%且≤11.0%(本地实验室);随机前(V3)HbA1c≥7.0%且≤10.5%(中心实验室);
5、空腹血糖(FPG)必须满足以下标准:筛选时FPG<15mmol/l(本地实验室);随机前(V3)FPG<15mmol/l(中心实验室);
6、筛选时或随机前(V3)体重指数(BMI)≥18.5kg/m2且≤40.0kg/m2
7、能够理解并且愿意签署书面知情同意书(ICF)并遵守研究方案
排除标准
1、被诊断为1型糖尿病、因胰腺损伤引起的糖尿病或由其他疾病引起的特殊类型糖尿病(如肢端肥大症或Cushing综合征)者
2、筛选时空腹C肽<0.8ng/mL
3、筛选前8周内或随机前使用过除二甲双胍以外的其他降糖药物、全身性糖皮质激素(吸入用或局部外用除外)、生长激素者
4、筛选前6个月内或随机前连续使用胰岛素的时间超过14天(妊娠期糖尿病接受胰岛素治疗的时间不在此限定范围内)
5、筛选或随机前曾接受其他葡萄糖激酶激活剂治疗者
6、筛选前6个月内或随机前出现糖尿病急性并发症,如糖尿病酮症酸中毒、乳酸酸中毒或高血糖高渗状态
7、筛选前6个月内有严重的糖尿病慢性并发症(如增殖性糖尿病视网膜病变、严重的糖尿病神经病变、糖尿病足等)
8、筛选前6个月内曾经发生2次或2次以上严重低血糖或筛选时至随机前发生过严重低血糖
9、筛选前6个月内或随机前发生以下任何心脏疾病:
失代偿性心功能不全(纽约心脏病协会心功能分级NYHA为III级或IV级);
急性心肌梗死、不稳定型心绞痛、冠状动脉旁路移植术或冠脉球囊扩张或支架植入;
严重的心律失常(如II度或III度房室传导阻滞、长QT综合征或QTcF>480ms);
需要治疗的心律失常,或其它经研究者评估不适合参加本临床研究
10、筛选时或随机前高血压未得到有效控制者(休息≥5分钟后,坐位收缩压≥160mmHg和/或舒张压≥100mmHg)
11、筛选前6个月内或随机前发生出血性脑卒中或急性缺血性脑卒中疾病
12、筛选时或随机前患有严重肾脏疾病或估算肾小球滤过率eGFR<60mL/(min?1.73m2)或尿常规中尿蛋白定性≥(++)或尿蛋白定量≥1g/L
13、筛选时或随机前具有急性或慢性胰腺炎病史
14、筛选前6个月内或随机前患有任何影响药物吸收的严重胃肠道疾病(如胃轻瘫、炎症性肠病、肠梗阻),或曾经接受过影响药物吸收的胃肠道手术(如胃切除术、胃肠造口吻合术或肠道切除术等)
15、筛选前1个月内或随机前发生过可能会影响血糖控制的严重外伤或严重感染者,例如骨折、肺炎等
16、筛选前5年内或随机前有任何类型治疗或未经治疗的恶性肿瘤(无论治愈与否)者,但已治愈的皮肤基底细胞癌无需排除
17、筛选时伴有未能以稳定药物剂量控制的甲状腺功能异常,或筛选时甲状腺功能检查结果存在具有临床意义的异常且需要药物治疗者
18、筛选时实验室检查有以下任何异常者:人类免疫缺陷病毒抗体或梅毒螺旋体特异性抗体阳性;丙型肝炎抗体阳性;乙型肝炎表面抗原阳性,且乙肝病毒DNA定量检测结果高于检测参考范围的下限
19、筛选时或随机前实验室检查有以下任何异常者:丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)>2倍正常值上限(ULN),或总胆红素>1.5×ULN;血红蛋白<110g/L;空腹甘油三酯≥5.7mmol/L
20、筛选时或随机前患有任何可能引起溶血或红细胞不稳定而影响HbA1c检测的疾病,如溶血性贫血等
21、筛选前90天内或随机前有>400ml的献血史、输血史或失血史
22、在筛选前3个月内或随机前受试者参加过任何药物或医疗器械临床研究(筛选失败或未接受任何试验药物者除外)
23、既往有明确诊断的精神疾病病史,不愿意或不能充分理解和合作;或研究者评估不适合参加本研究者
24、既往嗜酒者[(每天饮酒>2单位且每周饮酒>14单位(饮酒1单位相当于葡萄酒150mL或啤酒350mL或烈酒50mL)]或有药物滥用史者
25、已知对试验药物或维格列汀或其辅料过敏或不耐受者,或存在禁忌者
26、目前正在采用强效或中效的肝酶CYP3A4诱导剂进行治疗
27、妊娠或哺乳期的女性
28、男性受试者的伴侣或女性受试者计划怀孕或自签署知情同意书开始至末次用药后30天内不能或不愿意使用方案认可的避孕措施者
29、单盲导入期二甲双胍或安慰剂依从性<80%或>120%
30、研究者判断,受试者不能够遵守本方案要求,如在研究期间不能坚持饮食和运动治疗,不能按照方案要求按时服药与进餐,不能及时进行自我血糖监测(SMBG)并记录等
31、研究者认为不适合参加本临床研究的其他情况