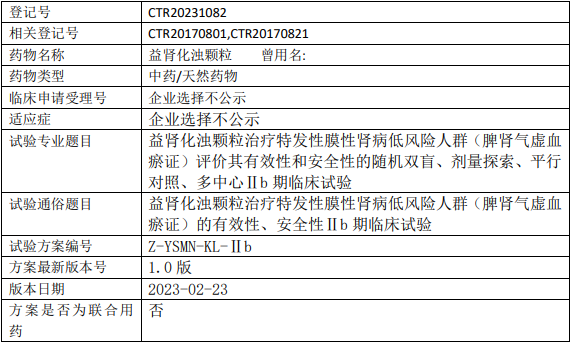
天津药物研究院益肾化浊颗粒临床试验,益肾化浊颗粒治疗特发性膜性肾病低风险人群(脾肾气虚血瘀证)有效性和安全性的Ⅱb期临床试验
试验目的
1、探索益肾化浊颗粒治疗特发性膜性肾病低风险人群(脾肾气虚血瘀证)的有效性;
2、观察益肾化浊颗粒临床应用的安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18~75周岁;
2、符合西医特发性膜性肾病诊断,既往肾穿检查明确病理类型为膜性肾病,或既往无肾穿检查但抗PLA2-R抗体阳性的患者;
3、符合中医脾肾气虚血瘀证者;
4、24h尿蛋白定量0.5~3.5g/d的低风险人群;
5、eGFR≥60ml/min/1.73m2(采用CKD-EPI公式);
6、知情同意过程符合规定,签署知情同意书。
排除标准
1、肾功能进行性减退,肾活检示严重肾小管间质病变;
2、血浆白蛋白<25g/L;
3、血钾>5.5mmol/L;
4、合并心脑血管、胃肠道、内分泌、凝血功能障碍等严重原发性疾病,血糖控制不佳;
5、合并有肝炎及其它肝脏基础疾病、结缔组织病者;
6、既往患有恶性肿瘤或有恶性肿瘤病史、精神病史或其他不能合作者;
7、筛选前6个月曾接受糖皮质激素、免疫抑制剂、细胞毒药物、生物制剂治疗者;
8、妊娠期妇女、哺乳期妇女或有妊娠计划的妇女;
9、对试验药物及其辅料过敏者;
10、筛选前30天内参加过其他临床试验者;
11、经研究者判断不宜入选本试验者。