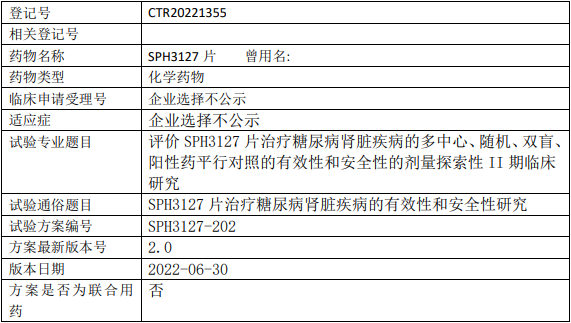
上海医药SPH3127临床试验,评价SPH3127片治疗糖尿病肾脏疾病的多中心、随机、双盲、阳性药平行对照的有效性和安全性的剂量探索性II期临床试验
试验目的
以缬沙坦为对照,初步评价肾素抑制剂SPH3127片对糖尿病肾脏疾病患者尿蛋白改善的有效性及用药安全性,确定推荐剂量。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄:18~75周岁;
2、性别:男女不限;
3、诊断为2型糖尿病,在筛选前12个月内至少使用过一种降糖疗法,筛选期血糖基本保持稳定;
4、筛选期坐位120mmHg≤SBP≤160mmHg且DBP<110mmHg;
5、随机前实验室检查需满足:
1)-8w、-4w、-2w、0w中至少两次满足30mg/g≤UACR<3000mg/g;
2)-4w、0w时eGFR≥45mL/min/1.73m2;
3)0w时AST及ALT≤2倍正常值上限,及总胆红素≤1.5倍正常值上限;
4)0w时血红蛋白≥90g/L;5)-4w、0w满足3.5mmol/L≤血钾≤4.8mmol/L;
6、受试者同意在整个研究期间及末次服药12周内与其配偶采取有效避孕措施;
7、试验前详细了解试验性质、意义、可能的获益、可能带来的不便和潜在危险,理解研究程序且自愿签署知情同意书。
排除标准
1、基线(0w)坐位SBP>140mmHg和(或)DBP>90mmHg;
2、肾动脉彩超检查单侧或双侧肾动脉狭窄≥50%;
3、①急性肾功能不全:筛选期eGFR变化幅度≥30%
②急性肾炎综合征、多囊肾、肾结石(B超证实)、肾病综合征;
③患者蛋白尿有证据表明源于除高血压肾损害以外的原继发性肾脏疾病;
④1年内有肉眼血尿者。
4、筛选期/导入期,经研究者判断受试者由于其他基础疾病控制不佳,需对相应治疗方案进行重大调整者;
5、有恶性高血压眼底改变,如视网膜出血、视乳头水肿;
6、研究期间需要持续服用糖皮质激素、抗肿瘤化学药物或生物制剂、非甾体类抗炎药(除外<275mg/日阿司匹林);
7、随机前3个月内有急性心肌梗死、冠状动脉血管重建、IV级(NYHA)心衰、急性脑梗死、脑出血、一过性脑缺血发作史;
8、甲状腺功能检查异常且有临床意义者;
9、糖尿病控制不佳:0w的HbA1c≥9.0%;
10、筛选前3个月内接受过重大手术、或需要在试验期间接受重大手术者;
11、导入期内服药依从性<80%或>120%者;
12、有可能显著改变药物吸收、分布、代谢、排泄的胃肠外科手术史(如:胃切除术、胃肠吻合术或肠切除术、胃旁路术、胃肠吻合、胃肠束带手术等);
13、已知对肾素抑制剂、ARB、ACEI类药物及其赋形剂过敏者或高敏体质者,严重不良反应者;
14、妊娠期、哺乳期女性;
15、随机前及试验期间需要进行移植的患者;
16、HIV感染、乙肝感染、丙肝感染、或其他活动性感染等;
17、既往有恶性肿瘤病史者,疑诊肿瘤者;
18、既往及目前有精神-心理疾病病史者;
19、筛选前2年内有药物滥用史或酗酒史;
20、筛选前3个月内作为受试者参加过其他药物/器械临床试验;
21、研究者认为任何不宜参加本试验的其他疾病或情况。