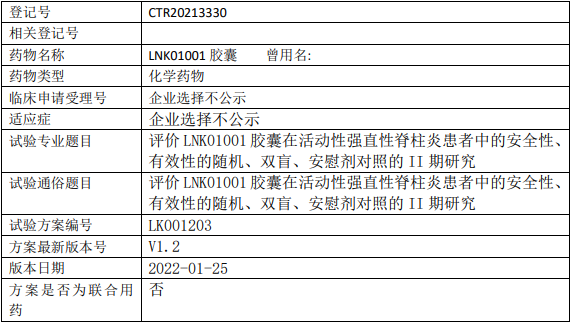
凌科药业LNK01001临床试验,评价LNK01001胶囊在活动性强直性脊柱炎患者中安全性、有效性的II期临床试验
试验目的
主要目的
评价LNK01001在活动性AS受试者中的安全性和有效性。
次要目的
测定LNK01001在活动性AS受试者体内的血浆药物浓度,探索LNK01001在活动性AS受试者中的PK特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.年龄为18~75周岁(包含临界值,以签署ICF时间为准)的男性或女性受试者。
2.根据1984年强直性脊柱炎纽约修订标准被诊断为AS(具备第④条并附加①~③条中的任何1条可确诊为AS):
①下腰背痛持续至少3个月,疼痛随活动改善,但休息不减轻;
②腰椎在前后和侧屈方向活动受限;
③胸廓扩展范围小于同年龄和性别的正常值;
④双侧骶髂关节炎II~IV级,或单侧骶髂关节炎III~IV级。
3.受试者必须有记录AS诊断的骶髂关节放射照片(骨盆AP位)。
4.受试者在筛选访视和基线时疾病处于活动期,定义如下:BASDAI评分≥4,且脊柱痛评分≥4。
5.接受过非甾体类抗炎药(NSAID)治疗,但仍存在活动性AS的受试者,或对NSAID不耐受或禁忌。定义如下:基线前受试者须至少累计出现2次临床反应不足(每一种NSAID使用时间≥2周,使用总时间≥4周)或至少对2种不同的口服NSAIDs不耐受;不耐受定义为因相关AE(例如:过敏反应、胃肠道症状或体征等)而停止NSAID治疗;若筛选时仍在接受NSAIDs治疗者,则剂量需稳定至少2周。
6.随机前,受试者可能从未接受生物制剂治疗,也可能既往接受过最多1种生物制剂治疗。
既往接受过生物制剂治疗的受试者必须满足以下要求:
a)研究者认为既往至少12周以上的治疗应答不充分,或
b)曾出现治疗不耐受(如出现导致生物制剂停药的副作用/AE)。
c)随机前至少已停用5个半衰期(常见生物制剂半衰期见章节17.9:附录9以供参考)
7.接受其他非禁止的合并用药的受试者在本研究首次给药前的至少7天内应维持稳定的用药方案。
8.受试者充分了解研究的内容、目标和特征,并可以按计划完成研究。自愿作为受试者,并能够签署ICF。
排除标准
1.受试者患有活动性纤维肌痛或全脊柱强直(“竹节状脊柱”),或任何其他炎症性关节炎,如类风湿性关节炎、系统性红斑狼疮、结节病。
2.受试者存在由研究者认为可能会干扰有效性评估的继发性非炎症情况(如骨关节炎)。
3.受试者有以下活动性感染或感染史:
a)随机前12周内有任何活动性感染(普通感冒除外)。
b)随机前2个月内出现严重感染,即需要住院或静脉注射抗感染药治疗。
c)研究者认为机会性、复发性或慢性感染史可能会导致本研究对受试者不利。机会性感染是由不常见的病原体(例如,耶氏肺孢子虫、隐球菌)引起的感染,或由常见病原体(例如,巨细胞病毒、带状疱疹病毒)引起的异常严重感染。
4.梅毒螺旋体抗体或人类免疫缺陷病毒(HIV)抗体检查结果中任意一种或两种均呈阳性;乙型肝炎表面抗原(HBsAg)阳性者;乙型肝炎核心抗体(HBcAb)阳性(+)的受试者,同时乙型肝炎病毒脱氧核糖核酸(HBV-DNA)聚合酶链反应(PCR)的定量检测结果为高于检测下限者。活动性丙型肝炎患者,定义为已知丙型肝炎病毒抗体(HCVAb)阳性和已知定量HCV核糖核酸(RNA)结果大于检测下限。
5.胸部X线检查提示活动性结核;X线检查提示为非活动性结核的受试者,研究者认为有必要时需加做QUANTIFERON®-TBGOLD检查(例如曾使用过TNF-α拮抗剂),如阳性需排除;隐匿结核感染者,界定为结核菌素皮试(PPD)硬结大于5mm或结核感染T细胞检测(T-SPOT.TB)阳性者,且未经预防性结核治疗满4周。
6.受试者在筛选访视前5年内有任何活动性恶性肿瘤或恶性肿瘤病史,除经治疗且认为已治愈的皮肤鳞状或基底细胞癌、宫颈原位癌或乳腺导管原位癌之外。
7.受试者有淋巴增生疾病病史,包括淋巴瘤或目前提示淋巴增生疾病的体征和症状。
8.受试者曾接受过器官移植。
9.既往1年内有过上消化道出血或消化道溃疡病史或血栓栓塞病史者。
10.受试者在随机前6个月内患有活动性葡萄膜炎。
11.受试者在随机前3个月内过大手术(包括关节手术),或在进入研究后6个月内计划进行大手术。
12.受试者患有研究者认为在研究过程中不可控、不稳定或可能发展到临床显著程度的任何系统性疾病(如肾功能衰竭、心脏衰竭、高血压、肝脏疾病、糖尿病、血栓栓塞疾病)。
13.合并严重关节外表现,如高热不退、间质性肺炎、胸膜炎、心包炎、严重血管炎、神经系统病变等的患者。
14.在入组研究前4周内和/或参加研究期间,参加了其他研究用药品研究(筛选期内的非干预性随访除外)。
15.受试者的用药符合了表3(见章节8.5.2)的排除标准,例如基线访视前6个月内使用过JAK抑制剂;或者既往使用JAK抑制剂治疗应答不充分。
16.随机前12周内,接受过活(减毒)疫苗治疗。
17.受试者在基线访视前1个月或5个半衰期内(以较长者为准),在临床研究范围内或外接受了表3(见本章节后文)中未列明的用于治疗AS的非生物治疗。
18.对研究药物(及其辅料)和/或同类产品的成分有过敏反应史或显著敏感史。
19.随机前4周内使用CYP2C9的强抑制或强诱导药物;
20.受试者的筛选期实验室检测结果异常,满足以下任意一条标准:
a)血压:收缩压(SBP)>150mmHg和/或舒张压(DBP)>90mmHg;患有高血压且经两种或两种以上降压药治疗仍满足上述标准者。
b)肝功:丙氨酸转氨酶(ALT)≥2倍正常值上限,或天门冬氨酸转氨酶(AST)≥2倍正常值上限,或总胆红素≥1.5倍正常值上限。
c)肾功:肌酐≥1.5倍正常值上限。
d)血常规:血红蛋白<10g/dL;白细胞绝对计数<3.0×109/L(<3000mm3);中性粒细胞绝对计数<1.5×109/L(<1500mm3);血小板计数<100×109/L(<100000/mm3)。
e)研究者认为将妨碍受试者完成研究或干扰对研究结果的解释的任何其他异常实验室检测结果。
21.受试者的筛选期12导联ECG结果QTc≥500mm;
22.随机前12个月内曾酗酒、吸毒或滥用药物;
23.受试者有任何其他被研究者认为不适合参与研究的疾病,包括医学或精神疾病。
24.计划怀孕或已怀孕或正在哺乳期的女性受试者,或整个试验期间及末次用药后3个月内无法采取有效避孕措施者。
25.研究者认为由于其他任何原因不适合参加本试验的受试者。
研究者信息
主要研究者
姓名:曾小峰
学位:医学
博士职称:主任医师
单位名称:中国医学科学院北京协和医院
各参加机构
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 中国医学科学院北京协和医院 | 曾小峰 | 北京市东城区帅府园1号 |
| 2 | 蚌埠医学院第一附属医院 | 王信 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 3 | 中山大学附属第七医院 | 古洁若 | 广东省深圳市光明区新湖街道圳园路628号 |
| 4 | 南京大学医学院附属鼓楼医院 | 孙凌云 | 江苏省南京市鼓楼区中山路321号 |
| 5 | 苏州大学附属第一医院 | 武剑 | 江苏省苏州市姑苏区平海路899号 |
| 6 | 华中科技大学同济医学院附属同济医院 | 董凌莉 | 湖北省武汉市硚口区解放大道1095号 |
| 7 | 天津医科大学总医院 | 魏蔚 | 天津市和平区鞍山道154号 |
| 8 | 山东大学齐鲁医院 | 刘花香 | 山东省济南市历下区文化西路107号 |
| 9 | 吉林大学第一医院 | 姜振宇 | 吉林省长春市朝阳区新民大街71号 |
| 10 | 浙江大学医学院附属第二医院 | 吴华香 | 浙江省杭州市上城区解放路88号 |
| 11 | 温州医科大学附属第一医院 | 孙莉 | 浙江省温州市瓯海区上蔡村南温医一院新院区 |
| 12 | 郑州大学第一附属医院 | 刘升云 | 河南省郑州市二七区建设东路1号 |
| 13 | 南昌大学第一附属医院 | 吴锐 | 江西省南昌市东湖区永外正街17号 |
| 14 | 延边大学附属医院 | 金京春 | 吉林省延边朝鲜族自治州延吉市局子街1327号 |
| 15 | 九江市第一人民医院 | 刘炬 | 江西省九江市浔阳区塔岭南路48号 |
| 16 | 南方医科大学南方医院 | 杨敏 | 广东省广州市广州大道北1838号 |
| 17 | 首都医科大学宣武医院 | 赵义 | 北京市西城区长椿街45号 |
| 18 | 河北中石油中心医院 | 勾威 | 湖北省廊坊市广阳区新开路51号 |
| 19 | 济宁市第一人民医院 | 李树杰 | 山东省济宁市任城区健康路6号 |
| 20 | 萍乡市人民医院 | 胡建康 | 江西省萍乡市安源区武功山中大道8号 |
| 21 | 北京医院 | 张烜 | 北京市东城区东单大华路1号 |