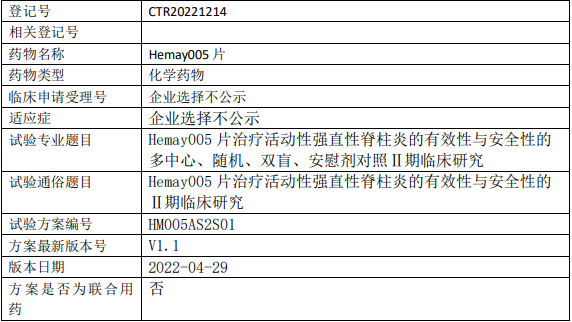
和美药业Hemay005临床试验,Hemay005片治疗活动性强直性脊柱炎的有效性与安全性的期临床试验
试验目的
主要目的
以安慰剂平行对照来评价Hemay005片治疗活动性强直性脊柱炎(ankylosingspondylitis,AS)的有效性。
次要目的
评估口服Hemay005片在活动性AS患者中的安全性。评价Hemay005片在活动性AS患者中的群体药代动力学特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.理解并自愿签署本研究的知情同意书;
2.18~65岁(包含边界值),性别不限;
3.50kg≤男性体重<100kg,45kg≤女性体重<100kg;
4.人类白细胞抗原(humanleukocyteantigen,HLA)-B27检测结果阳性;
5.能够遵守随访日程安排和其它方案要求;
6.确诊为AS(修订的纽约标准1984),对AS诊断如下:下腰背痛持续至少3个月,疼痛随活动改善,但休息不减轻;
7.受试者需至少满足以下1)、2)的要求:
1)Bath强直性脊柱炎病情活动指数(BathAnkylosingSpondylitisDiseaseActivityIndex,BASDAI)≥4,且慢性腰背痛≥4(患者背痛强度评估问题1)(NRS评分);
2)随机前至少使用过一种非甾体抗炎药(nonsteroidalantiinflammatorydrugs,NSAIDs)而症状未缓解或药物不耐受或存在药物禁忌症,即随机前使用1种NSAIDs推荐剂量下至少稳定使用4周或使用≥2种NSAIDs,每种NSAIDs稳定使用≥2周)或无法耐受;
3)受试者如发生以下3条标准中所规定的任一情况,则应也同时满足相应的规定:
(1)正在接受NSAIDs、口服糖皮质激素类(每日口服糖皮质类激素剂量≤10mg的强的松或等效剂量的其他类似物)和/或环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂的患者,在随机前至少14天和整个研究期间使用剂量稳定;
(2)对于合并使用柳氮磺吡啶的患者:随机前至少12周就开始服用柳氮磺吡啶[≤3g/天]且剂量和给药途径在随机分配前已至少稳定4周的受试者可以在研究期间维持剂量继续服用;
(3)对于既往使用肿瘤坏死因子(tumornecrosisfactor,TNF)-α抑制剂的患者:使用TNFα抑制剂的受试者对至少12周批准剂量的治疗反应不足,或对治疗不耐受;
8.必须符合以下实验室标准:
血红蛋白(hemoglobin,Hb)≥9g/dL血细胞比容≥27%
白细胞(whitebloodcell,WBC)计数≥3000/μL(≥3.0×109/L)且<20,000/μL(<20×109/L)
中性粒细胞(neutrophil,Neu)≥1500/μL(≥1.5×109/L)
血小板(platelet,PLT)≥100,000/μL(≥100×109/L)
血清肌酐(creatinine,Cr)≤1.5mg/dL(≤132.6μmol/L)
总胆红素(totalbilirubin,TBIL)≤2.0mg/dL
天冬氨酸氨基转移酶[aspartateaminotransferase,AST(血清谷氨酸草酰乙酸转氨酶,serumglutamic-oxaloacetictransaminase,SGOT)]和丙氨酸氨基转移酶[alaninetransaminase,ALT(血清谷氨酸丙酮酸转氨酶,serumglutamic-pyruvictransaminase,SGPT)]≤1.5倍正常上限(upperlimitsofnormal,ULN);
9.自从签署知情同意书开始的整个研究期间以及研究药物末次给药后3个月内,有生育能力的女性受试者和未接受输精管结扎术的男性受试者愿意采取有效避孕措施[有效避孕措施包括:
输精管结扎术、禁欲、宫内避孕器(IntrauterineDevice,IUD)、激素(口服、贴剂、环、注射、埋植)及屏障法(隔膜、宫颈帽、海绵、避孕套)];
有生育能力的女性受试者随机前7天内的血清妊娠试验[人绒毛膜促性腺激素(humanchorionicgonadotropin,hCG)]检查必须为阴性;
男性受试者在研究药物首次给药至末次给药后3个月内不能捐献精子
[注:有生育能力定义为:经历过初潮、未接受过绝育手术(子宫切除术/双侧卵巢切除术/双侧输卵管结扎)、已接受绝育手术但未满6个月的非绝经女性(绝经指持续自然停经≥12个月)]。
排除标准
1.存在以下疾病或疾病史:
1)脊柱完全强直者或骶髂关节完全融合者;
2)存在其他风湿性自身免疫性疾病的病史者(例如系统性红斑狼疮,类风湿性关节炎等);
3)有结核病史或活动性结核患者(筛选时存在研究者判断的活动性结核病的体征或症状):
如果患者既往有结核病史,经研究者评估在随机前已经治愈至少3年,那么允许进行筛选;
筛选期结核感染T细胞检测(T-SPOT)为阴性的受试者可以纳入本研究。
筛选期T-SPOT为阳性的受试者需进行结核相关临床检查(随机前12周内进行的结核相关临床检查可直接用于评估),若结核相关临床检查确认为活动性结核,则受试者不能入选本研究;若结核相关临床检查确认为非活动性结核,则受试者可以纳入本研究。
若研究中心无法进行T-SPOT检测,也可接受QuantiFERON-TBGold检测试剂盒进行的结核筛查,针对QuantiFERON-TB-Gold筛查结果的处理同T-SPOT;
4)患有恶性肿瘤,或筛选前5年内任何恶性肿瘤史者(经过治疗且过去12周内无再发证据的皮肤原位鳞癌、基底细胞癌或宫颈原位癌除外);
5)筛选前1个月内存在活动性感染的证据,包括急慢性感染以及局部感染,如败血症、脓肿、蜂窝组织炎及机会性真菌(如念珠菌)感染(可由研究医生结合患者具体情况判断);
6)严重基础疾病患者,如心脏、肺、肾脏、肝脏、神经、内分泌、胃肠道、代谢性或血液系统疾病、中度至重度充血性心力衰竭(纽约心脏病协会Ⅲ或Ⅳ级);
7)有酒精或药物滥用或依赖史,或精神疾病史者;
8)有可能影响口服药物吸收的情况,如胃大部切除术、临床显著的糖尿病性胃肠病或某些类型的减肥手术如胃旁路手术,不包含简单将胃隔成单独腔室的手术如胃束带手术;
2.孕妇或哺乳期妇女;
3.对本研究药物或其制剂成分过敏或过敏体质者;
4.筛选前6个月内接受过或试验期间计划进行大型手术(包括脊柱手术或关节手术)者;
5.筛选前3个月内参加过任何药物或医疗器械的临床试验者;
6.试验期间计划接种减毒或活疫苗者
7.正在服用或有以下用药史:
1)在随机前4周内使用改善病情抗风湿药物[disease-modifyinganti-rheumaticdrugs,(DMARDs)甲氨蝶呤,青霉胺,柳氮磺胺吡啶,硫唑嘌呤,羟氯喹]者,按照稳定剂量使用柳氮磺胺吡啶的患者除外,其他未列出的非生物制剂按5个药物半衰期(或4周,以较长者为准)进行洗脱;
2)在随机前4周内使用静脉内或关节内皮质类固醇(以较长者为准)者;
3)随机化前8周内使用依那西普、阿达木单抗,依法珠单抗、英夫利昔单抗、阿法西普者,其他未列出的生物制剂类别按5个药物半衰期(或8周,以较长者为准)进行洗脱;
4)随机化前使用过阿普斯特者;
5)随机化前4周内使用强细胞色素P450酶诱导剂者(例如,利福平、苯巴比妥、卡马西平、苯妥英钠);
6)随机化前2周内使用雷公藤等中成药或中药汤剂者;
8.筛查时12导联心电图存在任何临床显著异常者,且经研究者评估参加本研究可能会增加受试者的风险或干扰数据解读;
9.筛查时胸部X线(chestXray,CXR)或电子计算机断层扫描(computedtomography,CT)临床显著异常者,且经研究者判断可能使受试者处于安全性风险之中;
10.乙肝病毒表面抗原(hepatitisBsurfaceantigen,HBsAg)阳性、丙肝病毒抗体(hepatitisCVirusAntibody,HCVAb)阳性或人免疫缺陷病毒抗体(humanimmunodeficiencyvirusantibody,HIVAb)或梅毒螺旋体抗体检测阳性的受试者;
11.曾有自杀行为(包括积极尝试、中断的尝试或尝试未遂)或在过去的6个月内有自杀想法者;
12.研究者认为存在其他不适合参加试验的任何情况。
研究者信息
主要研究者
姓名:曾小峰
学位:医学博士
职称:主任医师
单位名称:中国医学科学院北京协和医院
各参加机构
| 序号 | 机构名称 | 主要研究者 | 地址 |
| 1 | 中国医学科学院北京协和医院 | 曾小峰 | 北京市东城区帅府园一号 |
| 2 | 西安交通大学医学院第一附属医院 | 何岚 | 陕西省西安市雁塔区雁塔西路277号 |
| 3 | 蚌埠医学院第一附属医院 | 张嵩 | 安徽省蚌埠市龙子湖区长淮路287号 |
| 4 | 萍乡市人民医院 | 胡建康 | 江西省萍乡市安源区武功山中大道8号 |
| 5 | 河北中石油中心医院 | 勾威 | 河北省廊坊市广阳区新开路51号 |
| 6 | 广东省人民医院 | 李洋 | 广东省广州市越秀区中山二路106号 |
| 7 | 华中科技大学同济医学院附属同济医院 | 涂胜豪 | 武汉市硚口区解放大道1095号 |
| 8 | 中山大学附属第三医院 | 古洁若 | 广东省广州市天河区天河路600号 |
| 9 | 吉林省人民医院 | 陈琳 | 吉林省长春市朝阳区工农大街1183号 |
| 10 | 濮阳市油田总医院 | 李凤菊 | 河南省濮阳市华龙区大庆路124号 |
| 11 | 郴州市第一人民医院 | 廖湘平 | 湖南省郴州市北湖区罗家井102号 |
| 12 | 山西医科大学第二医院 | 王晓霞 | 山西省太原市杏花岭区五一路382号 |