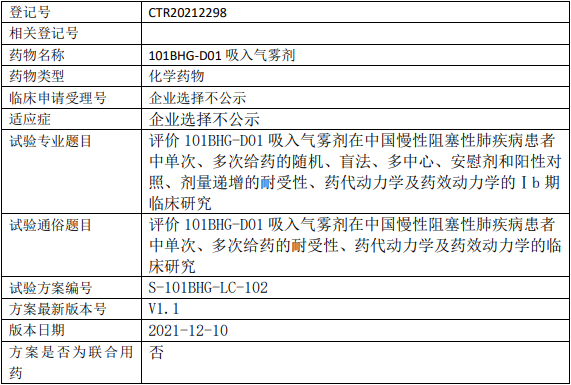
硕佰医药101BHG-D01临床试验,评价101BHG-D01吸入气雾剂治疗慢性阻塞性肺疾病的I期临床试验
试验目的
1、考察COPD患者单次、多次吸入101BHG-D01的耐受性和安全性;
2、考察101BHG-D01单次、多次吸入给药在COPD患者体内的药代动力学特征;
3、考察101BHG-D01单次、多次吸入给药后肺功能检查指标的变化;
4、根据Ⅰb期初步药效学结果,为II期临床试验推荐合适的给药剂量和方案。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:40岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.男性或女性,年龄40-75周岁之间(包括边界值)
2.体重:女性体重大于45kg,男性体重大于50kg,受试者体重指数(BMI))在19~30kg/m2之间(包括边界值)
3.当前吸烟,或者既往吸烟,吸烟史≥10包-年(包-年数=每日香烟数/20*吸烟年数)
4.肺功能检查:吸入支气管舒张剂后FEV1/FVC<70%,且30%≤FEV1<80%预计值
5.根据研究者判断,受试者愿意且能够按照方案要求调整当前COPD治疗
6.受试者必须在试验前对本研究知情同意,并自愿签署了书面的知情同意书
7.受试者能够与研究者作良好的沟通并能够依照研究规定完成本临床研究
排除标准
1.(问诊)不能耐受吸入给药方式者
2.(问诊)临床上有食物、药物过敏史,或已知对本品或其他抗胆碱能药物或β2肾上腺素受体激动剂及其辅料过敏者
3.(问诊)α-1抗胰蛋白酶缺乏症引发COPD的受试者
4.(问诊)在筛选前3天内患有发热性疾病者
5.(问诊)在筛选前6周内或导入期发生呼吸道感染,或导入期内发生COPD急性加重者
6.(问诊)筛选时稳定使用类固醇(包括ICS、口服激素、静脉激素)患者
7.(问诊)在筛选前1年内COPD中重度急性加重≥2次或因急性加重住院≥1次,且筛选时慢阻肺患者自我评估测试问卷(CAT)评分≥10分者
8.(问诊)使用长期氧疗(氧疗时间>15h/d)者
9.(问诊)既往行肺切除术,或筛选前12个月内接受肺减容术者
10.(问诊)患有肿瘤疾病(已经痊愈超过5年的原位子宫颈癌、皮肤鳞状细胞癌和基底细胞癌等受试者除外)者
11.(问诊)合并有慢性心脑血管、肝、肾系统疾病,且影响药物的分布、代谢、排泄等因素者
12.(问诊)患有青光眼、前列腺增生、尿路梗阻等病史者
13.(问诊)近2年内有药物滥用史,或药物滥用筛查(包括苯二氮卓、甲基安非他明、可卡因、吗啡、氯胺酮、四氢大麻酚酸)阳性者
14.(问诊)近2年内有酒精滥用史(即男性每周饮酒超过14个标准单位,女性每周饮酒超过7个标准单位,1标准单位含14g酒精,如360mL啤酒或45mL酒精量为40%的烈酒或150mL葡萄酒),或酒精呼气检查阳性者
15.(问诊)静脉采血困难或有晕针晕血史者
16.(问诊)给药前48小时内服用过特殊饮食(包括西柚、巧克力、茶、可乐,或者任何含咖啡因的食品或饮料、含酒精的饮料或其他影响药物吸收、分布、代谢、排泄的食品或饮料)者
17.(问诊)筛选前3个月内献血或失血大于400mL者
18.(问诊)筛选前30天内使用过任何抑制或诱导肝脏药物代谢酶CYP2D6或CYP3A4的药物(如:右美沙芬、曲马多、可待因、二氢可待因、羟考酮、二氢可待因酮、利培酮、氟西汀、氟伏沙明、帕罗西汀、艾司西酞普兰、西酞普兰、舍曲林、恩卡胺、美西律、氟卡胺、普罗帕酮、异喹胍、氟桂利嗪、普萘洛尔、阿普洛尔、卡维地洛、美托洛尔、肉桂嗪、地尔硫卓、克拉霉素、红霉素、维拉帕米、甲硝唑、小檗碱、环孢素、伊曲康唑、伏立康唑、西咪替丁、卡马西平、苯巴比妥、苯妥英钠、利福平、地塞米松等)者
19.(问诊)筛选期肺功能检查前不能按照以下药物规定时间内停药者:
全身用糖皮质激素、胃肠外(关节腔内等)局部注射用皮质类固醇、抗生素(用于治疗下呼吸道感染)30天;
茶碱类药物、磷酸二酯酶4(PDE4)抑制剂(如罗氟司特)、口服白三烯抑制剂(扎鲁司特、孟鲁司特、齐留通)、吸入性糖皮质激素(ICS)14天;
口服SAMA7天;吸入型LABA(沙美特罗、福莫特罗、奥达特罗和茚达特罗)72小时;
吸入型SABA(如硫酸沙丁胺醇、特布他林)、吸入型SAMA(如异丙托溴铵)、吸入型SAMA/SABA复方制剂、吸入型色甘酸钠或奈多罗米钠24小时;
任何其他研究性药物,30天或5个半衰期,以较长者为准
20.(问诊)筛选前3个月内参加过任何其他临床试验,或者在参加本试验期间有计划参加其他临床研究者
21.(问诊)女性受试者近两周内发生无保护性行为者或处于妊娠或哺乳期者;男性受试者(或其伴侣)或女性受试者在整个试验期间及给药后3个月内有生育计划或捐精捐卵者,试验期间不愿采取一种或一种以上的物理性避孕措施者,或女性受试者血妊娠试验阳性
22.基于研究者的判断,受试者目前诊断有哮喘(包括哮喘合并COPD);其他伴发的活动性或有临床意义的对研究有明显影响的呼吸疾病:如活动性肺结核、肺癌、支气管扩张、肺结节病、肺纤维化、肺动脉高压、肺间质性疾病或其他活动性肺脏疾病者
23.根据筛选期体格检查,CT检查,实验室检查(包括血常规、尿常规、血生化等),研究者判断异常有临床意义者,与COPD相关的除外
24.筛选时坐位收缩压≥160mmHg,坐位舒张压≥100mmHg;脉搏<55bpm或>100bpm
25.筛选时12导联心电图显示异常有临床意义者,或经校正的QT间期:QTcF*≤350毫秒或≥450毫秒
26.艾滋病毒检测、梅毒密螺旋体抗体、乙肝表面抗原及丙型肝炎病毒抗体检查任意一项阳性者
27.其他经研究者判断认为不适合参与本研究者
研究者信息
主要研究者
| 姓名 | 学位 | 职称 | 医院名称 |
| 杨汀 | 医学博士 | 主任医师 | 中日友好医院 |
| 李劲彤 | 医学博士 | 副研究员 | 中日友好医院 |
各参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 中日友好医院 | 杨汀 | 北京市朝阳区樱花园东街2号 |
| 2 | 中日友好医院 | 李劲彤 | 北京市朝阳区樱花园东街2号 |
| 3 | 首都医科大学附属北京同仁医院 | 刘晓芳 | 北京市东城区东交民巷1号 |
| 4 | 首都医科大学附属北京同仁医院 | 赵秀丽 | 北京市东城区东交民巷1号 |
| 5 | 首都医科大学附属北京安贞医院 | 刘泽英 | 北京市朝阳区安贞路2号 |
| 6 | 首都医科大学附属北京安贞医院 | 林阳 | 北京市朝阳区安贞路2号 |
| 7 | 无锡市人民医院 | 贺晴 | 江苏省无锡市南长区清扬路299号 |
| 8 | 东南大学附属中大医院 | 章锐锋 | 江苏省南京市鼓楼区丁家桥87号 |
| 9 | 河南省人民医院 | 张晓菊 | 河南省郑州市金水区纬五路7号 |
| 10 | 河南省人民医院 | 张伟 | 河南省郑州市金水区纬五路7号 |